生物正交化学在治疗领域潜力突出,基于该技术的前药激活策略——既能精准递药,又可通过非生物手段激活药物。但现有前药策略多聚焦细胞毒药物“解笼释放”,尚无增强药物在肿瘤内累积与渗透的递送方案。鉴于此,重庆医科大学梁洪文等人在 Journal of the American Chemical Society 发表了题为“Self-Assembly of Artificial Topological Nanostructures for Enhanced Bioorthogonal Activation and Drug Penetration for Cancer Immunotherapy”的研究论文,在人工拓扑纳米结构(ATNs)的基础上构建了ATNs催化体系的原位癌症疫苗。该体系通过协同整合酶诱导原位自组装技术与生物正交催化机制,不仅实现了前药的时空精准活化,还同步显著提升了活化药物在肿瘤组织中的穿透效率。
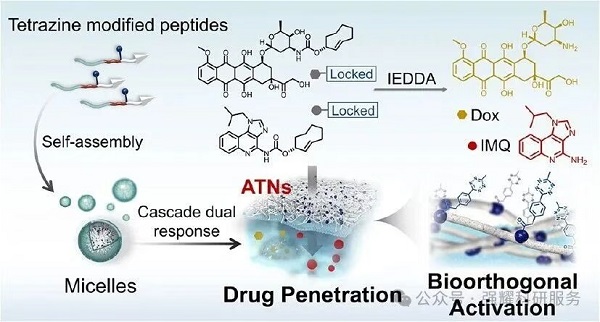
一、研究背景
现有疗法痛点
新抗原或 mRNA 癌症疫苗虽研发投入显著,但多数聚焦预防阶段,诱导患者产生强效抗肿瘤免疫反应仍面临挑战——核心瓶颈为疫苗免疫原性弱、肿瘤微环境(TME)呈免疫抑制状态,且疫苗抗原与患者个体肿瘤相关性低。
研究契机
针对上述瓶颈,以自体肿瘤细胞构建现场个性化癌症疫苗极具吸引力。自组装纳米材料可响应生理刺激形成 ATNs,能调节肿瘤血管、延长药物滞留时间;结合生物正交催化,或可实现 “精准激活 + 深层渗透” 协同。
二、研究设计
1. 关键分子设计
TMP(四嗪修饰肽)含 4 个核心单元,其结构与功能如下:
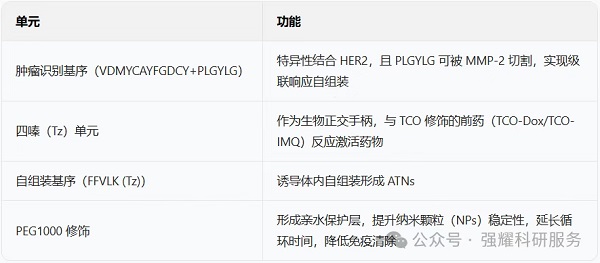
2. 作用机制
1、TMP 以 NPs 形式通过 EPR 效应富集于肿瘤部位;
2、肿瘤微环境中的 MMP-2 切割 TMP 的 PLGYLG 序列,释放 TzP 片段;③TzP 与癌细胞表面 HER2 结合,自组装形成 ATNs,暴露 Tz 位点;
3、Tz 与 TCO - 前药反应激活 Dox/IMQ,同时 ATNs 降低肿瘤密度、促进药物穿透;
4、激活的 Dox 诱导 ICD 释放 TAAs,IMQ 激活 DC 细胞,引发 CD8+T 细胞依赖的适应性免疫。
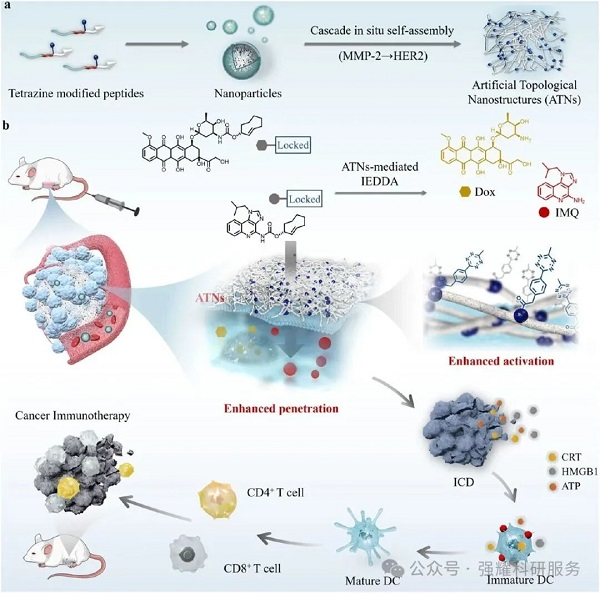
Fig1. 自组装人工拓扑纳米结构(ATNs)增强癌症免疫治疗中生物正交前药激活与药物穿透的机制示意图
三、研究结果
1. TMP 的自组装特性验证(体外)
(1)CAC测定:TMP 的临界聚集浓度为 0.47±0.06 μM,远低于 TzP(12.4±4.20 μM),说明其易自组装(图 2b/c);
(2)形态与结构:MMP-2 处理后,TMP NPs 从 91.3 nm 转变为 712 nm 的纳米纤维(ATNs)。TMP 可通过 MMP-2 介导的水解触发疏水相互作用与氢键形成,自组装为具有 β- 折叠结构的 ATNs(TEM/SEM/CD验证,图 2d-f/k);
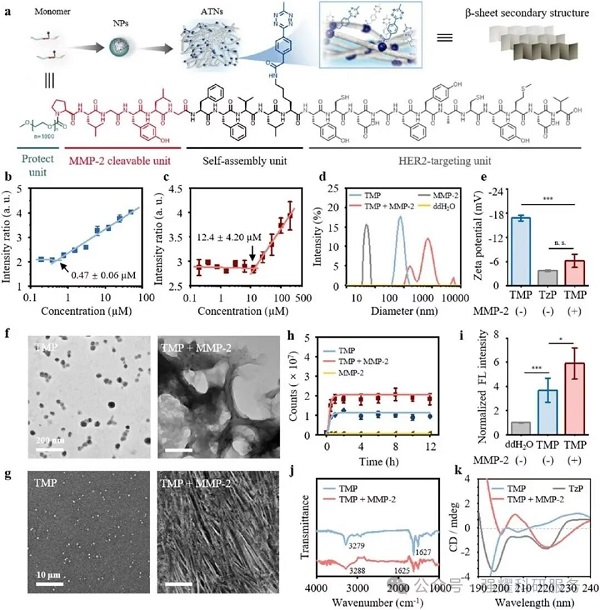
Fig2. 基质金属蛋白酶-2诱导的TMP分子组装机制的表征
(3)细胞靶向性:TMP 需同时依赖 MMP-2 切割与 HER2 靶向,才能在肿瘤细胞表面原位自组装为 ATNs,具备肿瘤细胞特异性,避免正常细胞干扰(图 3b/c)。
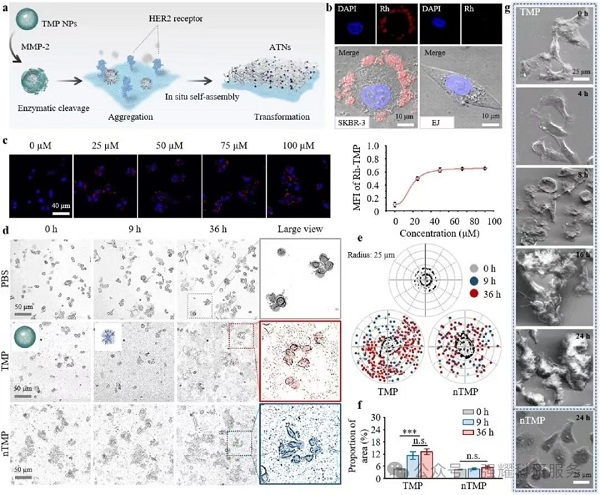
Fig3. TMP在细胞表面自组装成ATN
2. ATNs 介导的前药激活与免疫响应(体外)
(1)细胞毒性:在 SKBR-3 细胞中,TMP+TCO-Dox 的 IC50 为 0.56 μM,接近游离 Dox(0.16 μM),而 HER2 阴性细胞中无显著毒性(图 4c);
(2)ICD 诱导:TMP+TCO-Dox 组的 HMGB1 释放、CRT 膜暴露、胞外 ATP 水平显著高于对照组(分别提升 6.9 倍、13.3 倍,图 4i-l);
(3)免疫激活:与 TMP+TCO-Dox+TCO-IMQ 共孵育的 BMDC 细胞成熟率(CD11c+CD80+CD86+)达 32.5%,接近 Dox+IMQ 组(39.4%),且细胞因子(IL-12、IFN-γ)分泌显著升高(图 4n-o)。
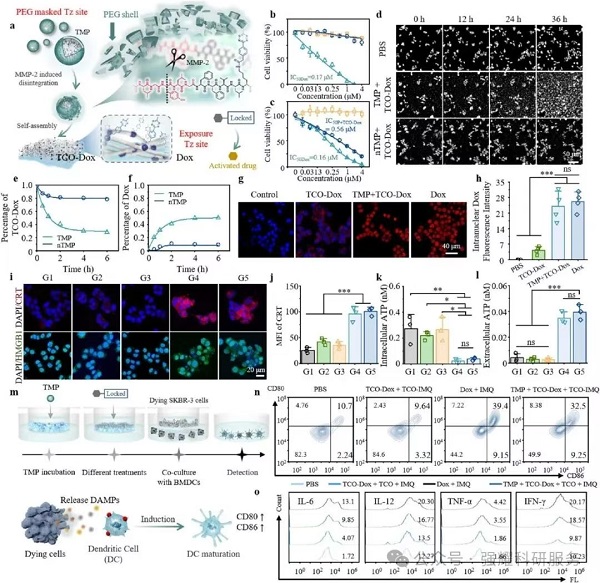
Fig4. ATNS介导的靶向前药物激活和体外免疫反应的协同促进
3. 体内药效与安全性
(1)肿瘤靶向与穿透:TMP 在肿瘤中的荧光强度是肝脏的 2.1 倍、肾脏的 21.0 倍;药物穿透深度 0.5 mm 处提升 7.8 倍,2.0 mm 处仍提升 5.7 倍(图 5c/i);
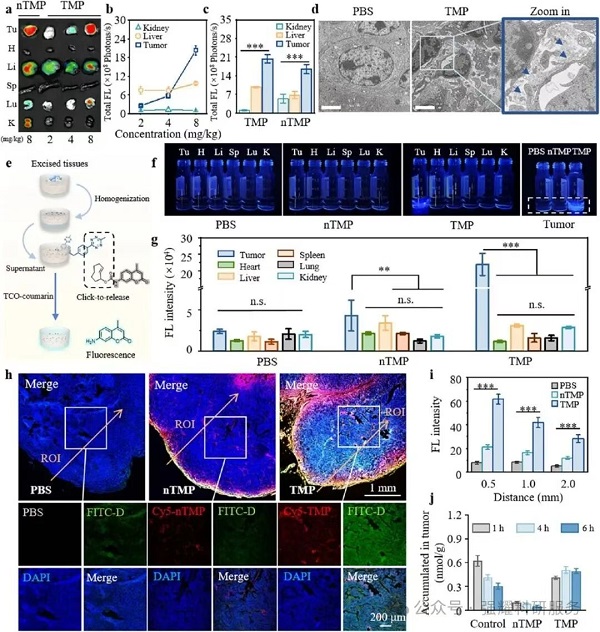
Fig5. 通过ATN催化系统增强药物在体内的精确活化和渗透
(2)抗肿瘤 efficacy:TMP+TCO-Dox+TCO-IMQ 组肿瘤抑制率超 70%,小鼠 30 天存活率 100%(游离 Dox 组全部死亡,图 6d-e);
(3)安全性:主要器官(肝、肾)无病理损伤,小鼠体重无显著下降(对比 Dox+IMQ 组的体重降低,图 6g)
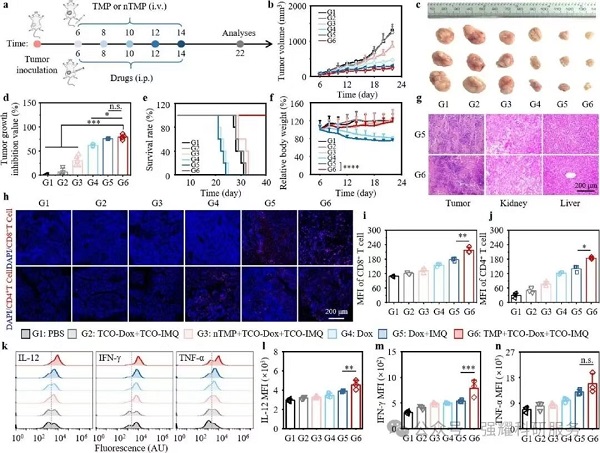
Fig6. 基于ATNS催化系统的原位疫苗的体内抗肿瘤和免疫刺激作用
4. 抗复发效果
ATNs 催化系统可有效抑制术后残留肿瘤生长,延长生存期,其机制可能与持续调控 TME、诱导免疫记忆相关,为肿瘤术后抗复发治疗提供新策略图 (7b-d)。
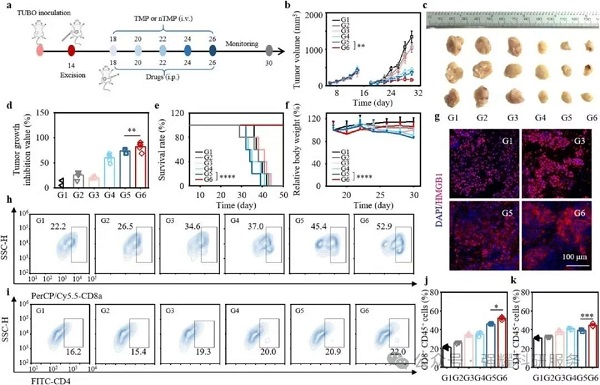
Fig7. 基于ATNS催化系统的原位疫苗体内抗肿瘤复发效果
四、总结与展望
本研究构建 ATNs 催化系统,兼具生物正交催化平台与肿瘤微环境调控的双重作用——既可为前药活化提供高效催化界面,又能通过抑制肿瘤细胞迁移与增殖、降低肿瘤组织密度以改善肿瘤组织物质传递微环境,最终协同促进肿瘤细胞对活化药物的摄取效率。
此外,ATNs 介导的靶向作用可精准诱导 ICD,进一步激活 CD8+T细胞依赖的适应性免疫应答,显著增强抗肿瘤效力。体内实验证实,该 ATNs 催化体系可将药物渗透提升 7.8 倍;且体内外实验均表明,基于 ATNs 的原位癌症疫苗在实现卓越抗肿瘤效果的同时,能有效降低正常器官/组织的剂量依赖性副作用,安全性与选择性优异。
该创新性 ATNs 催化体系在预防肿瘤复发中展现出良好治疗潜力,且适用性广泛,有望成为多种肿瘤前药递送的通用平台。尽管目前仍处研发早期,但原位自组装与生物正交催化结合的协同策略,必将为安全高效的原位癌症疫苗开发提供巨大助力。
本研究中TMP肽由强耀生物提供;强耀生物提供多肽合成,蛋白和抗体制备等优秀服务助力科研。


 联系我们
联系我们
 返回
返回