帕金森病(PD)是最常见与年龄相关的神经运动障碍,到65岁时影响约1%的人口,在85岁人群中增加到4-5%。其特征是中脑黑质致密部多巴胺神经元的丢失和α-突触核蛋白(α-synuclein,α-syn)聚集形成的路易小体以及路易神经突。α-syn是帕金森病致病机制研究中的关键蛋白。
α-突触核蛋白的结构
α-syn是一种丰富的神经元蛋白,在突触前神经末梢中高度富集。它含有140个氨基酸,由SNCA基因编码。该蛋白质由三个不同的区域组成:
(1)氨基末端(残基1-60):两亲性螺旋结构,介导了脂质膜的结合;家族性PD的常染色体显性遗传型起源于α-syn的N末端点突变和SNCA基因拷贝数增加(重复或三联)。
(2)中央疏水区域(61-95):NAC结构域(非Aβ成分),该区域被认为是检测α-syn聚集的重要指标;
(3)带高负电荷的羧基末端(残基96-140):高度酸性的不规则卷曲结构,是各种翻译后修饰的靶标,介导α-syn与金属、小分子和蛋白质的相互作用。
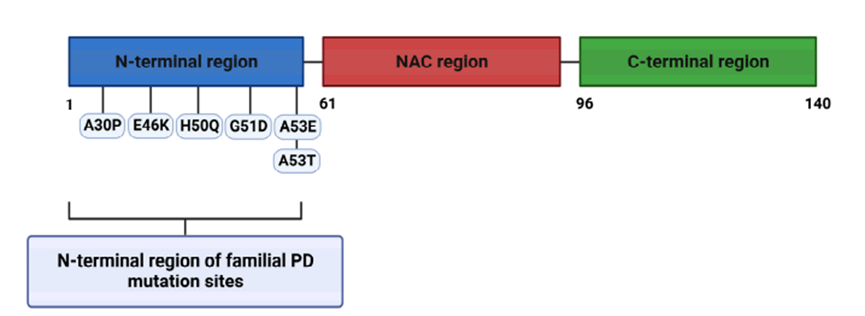
图1 α-突触核蛋白的结构和家族性PD突变的位置,doi:10.3390/ijms241311022
α-突触核蛋白与PD关系
α-syn与PD的首次联系出现于1997年,在家族型PD中,编码基因SNCA(也称为PARK1)的点突变,SNCA中的六种错义突变与常染色体显性遗传PD相关:A53T、A30P、E46K、H50Q、G51D、A53E。遗传研究表明,SNCA基因的突变促进了α-syn聚集体和原纤维的形成。随后鉴定出具有SNCA重复或三倍复制会增加α-syn的水平,增加PD风险。散发性PD患者的大脑中检测到SNCA的表观遗传沉默减少,PD患者脑脊液中α-syn寡聚体、磷酸化和聚集形式增加。表明了α-syn表达水平是PD发病的重要决定因素。
α-突触核蛋白在PD发病中的作用
α-syn的错误折叠和异常聚集是多巴胺神经元变性的重要原因。在生理状态下,α-syn形成的螺旋折叠四聚体结构,能够抵抗聚集。然而,在病理状态下,α-syn出现错误折叠,导致蛋白结构发生改变形成异常聚集体。α-syn在脑内异常聚集介导中枢神经系统各组成成分的病理改变导致多巴胺神经元变性、死亡,从而引发PD。细胞内α-syn水平受到α-syn合成、清除和聚集速率之间的平衡的严格调节。α-syn水平异常,使得寡聚体形成和积累的机制如下:
(1)影响α-syn合成的异常。编码α-syn的SNCA倍增、多态性以及SNCA突变(A53T、A30P、E46K突变),可能会增加细胞内α-syn水平并诱导其积累。
(2)α-syn降解失败也可能导致积累。清除缺陷可能是由于泛素-蛋白酶体系统(UPS)的故障、伴侣介导的自噬功能障碍(由PD相关突变引起)或蛋白酶功能障碍(神经蛋白或基质金属蛋白酶)引起的。
(3)其他因素。翻译后修饰、氧化应激、毒素以及与氧化多巴胺的相互作用会增加α-syn聚集和积累的倾向。
针对以上情况,从而可以产生相应的减少α-syn积累和聚集的靶向机制:
(1)使用Rep1、siRNA或miRNA减少蛋白质合成。
(2)通过激活参与清除的机制或蛋白质,例如自噬、蛋白酶体、神经素、MMP9和热休克蛋白,也可以减少积累。
(3)还使用抗聚集、抗氧化剂或翻译后修饰方法来减少α-syn的聚集。
(4)免疫疗法可用于阻止传播和寡聚体形成。
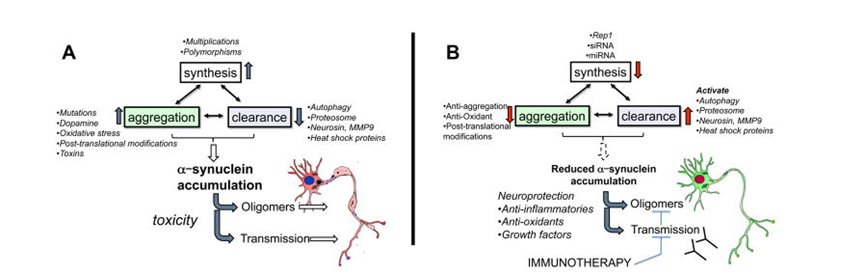
图2. α-突触核蛋白聚集增加及其减少策略,doi: 10.1038/nrn3406
靶向α-突触核蛋白的治疗
1
靶向α-Syn的免疫治疗
(1)主动免疫:使用全长人重组α-syn进行疫苗接种,能够降低路易体痴呆模型中聚集α-syn的水平。
(2)被动免疫:针对α-syn C末端的高选择性单克隆抗体MEDI134可有效减少α-syn在体内的病理传播。
(3)适配体:适配体是单链寡核苷酸(DNA或RNA),可以与一系列靶标(包括蛋白质)结合。两种DNA适配体被包装到RVG外泌体中以促进CNS递送,能够靶向α-syn并抑制细胞内α-syn聚集。
(4)纳米抗体:纳米抗体PFFNB2与腺相关病毒(AAV)编码的EGFP融合促进了纤维状α-syn的靶向,以限制朊病毒样α-syn在转基因小鼠中的传播。
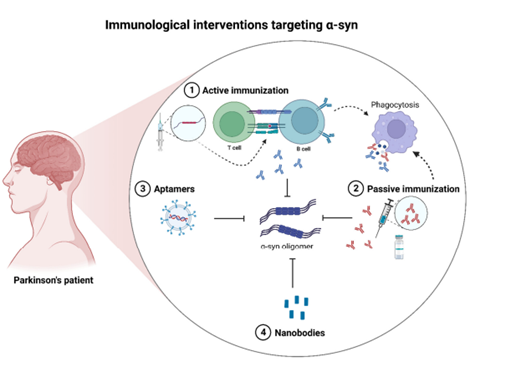
图3. 针对α-syn的免疫干预的主要策略,doi:10.3390/ijms241311022
2
靶向SNCA表达的机制
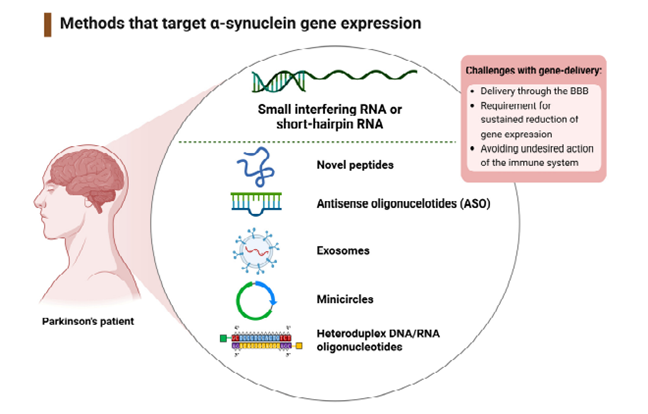
针对α-syn的基因治疗干预的主要策略,doi:10.3390/ijms241311022
3
靶向α-syn低聚物的治疗
(1)天然小分子化合物:角鲨胺可取代脂质囊泡表面的α-syn,并阻断α-syn聚集过程。
(2)热休克蛋白:如HSP70和CHIP可以通过多种机制减少α-syn低聚物,包括重折叠错误折叠的蛋白质、破坏蛋白质聚集体和促进蛋白质清除。
(3)寡聚物特异性抗体:mAb47是一种α-syn寡聚体选择性抗体,通过Fcγ受体进入人神经胶质瘤细胞,并中和细胞中毒性的α-syn聚集体。
(4)分子镊和适配体:CLR01分子镊被证明可以降低寡聚α-syn的水平,改善运动障碍。筛选的58个碱基DNA适配体以高亲和力结合α-syn,抑制α-syn寡聚化,并通过溶酶体途径促进α-syn的降解。
(5)受体拮抗剂:通过阻断α-syn低聚物结合的受体如靶向TLR1/2或TLR2,可以帮助减少低聚物引起的神经毒性。
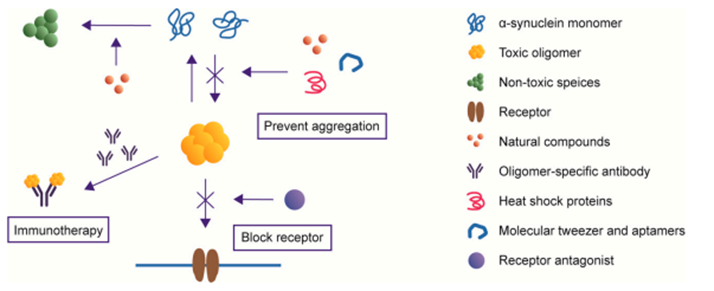
靶向α-syn低聚物的疗法,doi:10.3390/ijms21228645
体内动物研究已经证明了抗α-syn疗法在降低α-syn毒性和病理学方面的功效。总之,对抗α-syn聚集的策略的开发和测试是有希望的,并且可能会发现组合方法对于阻止疾病进展最有效。此外,如果与替代治疗策略(和作用机制)联合使用,例如使用重新利用的药物,这些新的疾病修饰疗法可能会得到更好的利用和更有效。
强耀生物15年来致力于为研究学者们提供多肽、蛋白和抗体等一站式服务,如用于研究帕金森病相关的突变型α-突触核蛋白(A53T、E46K等),具体详见:
https://www.chinapeptides.com/RecombinantProteins/index.aspx。
如果您有相关需求,请随时联系我们。


 联系我们
联系我们
 返回
返回