卵母细胞是几乎所有雌性哺乳动物(包括人类女性)在出生前就发育的未成熟卵细胞。未来世代繁殖都依赖于这一数量有限的细胞储备能够存活多年且不遭受损害。在人类中,这些卵母细胞能够在卵巢中存活近50年之久(也就是从出生到绝经的平均时间)。卵细胞如何实现如此长寿这一非凡壮举,一直是个未解决的问题。
2024年2月20日,巴塞罗那科学技术研究所和马克斯·普朗克多学科科学研究所的研究人员在国际顶尖学术期刊 Cell 上发表了题为:Mouse oocytes sequester aggregated proteins in degradative super-organelles 的研究论文。
该研究发现,蛋白质聚集物会影响卵母细胞质量和雌性生育能力,而卵母细胞中存在一种名为内溶酶体囊泡集结体(EndoLysosomal Vesicular Assemblies,简称ELVA),它们在卵母细胞质中漫游,像清洁团队一样捕获和固定蛋白质聚集物并使其无害化。如果这些蛋白质聚集物没有被有效清除,就会导致有缺陷的卵子的形成,60%的携带了这些蛋白质聚集物的小鼠胚胎无法完成早期发育。
这项研究揭示了卵母细胞健康长寿的潜在机制,也为探索卵母细胞质量差这一导致女性不孕症主要原因的机制提供了新方向。随着人类结婚和生育年龄的延迟,这项研究的意义和重要性不言而喻。

我们知道,在神经元等长寿、不分裂的细胞中,错误折叠或受损导致的毒性蛋白聚集与阿尔茨海默病等神经退行性疾病有关。有研究显示,毒性蛋白聚集也会影响卵母细胞质量和女性生育能力。
细胞通常会使用专门的酶来分解毒性蛋白聚集物,它们还可以分裂成两个新细胞,将聚集物集中在一个细胞中,而保证另一个细胞的安全。
但是,卵母细胞与其他细胞不同,超长寿命意味着它们无法通过细胞分裂来消除毒性蛋白聚集物。此外,不断分解这些蛋白质聚集物也不可行,因为这需要消耗大量能量,而这些能量可能无法获得。卵母细胞需要将来在与精子融合后将整个细胞质留给胚胎,因此它们倾向于减少代谢活动,以避免产生可能损害母体DNA并危及未来繁殖成功的副产物。这些原因使得卵母细胞对错误折叠或受损蛋白质的影响特别敏感。

Elvan Böke 研究员
已有成千上万篇论文研究了神经元中错误折叠或受损的蛋白质聚集,然而,同样具有长寿、不分裂特征的卵母细胞如何应对蛋白质聚集的问题,却基本没有人研究。因此,Elvan Böke 研究员想探索卵母细胞如何处理这些错误折叠或受损的蛋白质,以及卵母细胞为何如此长寿。
卵母细胞中的超级细胞器
在这项研究中,研究团队从成年小鼠身上收集了数千个未成熟的卵母细胞、成熟的卵子以及早期胚胎。然后通过活细胞成像技术实时观察其中的蛋白质聚集行为。他们还使用电子显微镜进行更近距离的观察,能够看到细胞内纳米尺度的细节,这项工作花了五年半时间才得以完成。
研究团队在卵母细胞中发现了一种特殊结构,他们将其命名为内溶酶体囊泡集结体(EndoLysosomal Vesicular Assemblies,简称ELVA),每个卵母细胞中大约有50个,它们在细胞质中漫游,捕获并固定蛋白质聚集物,使其无害化。
研究团队进一步揭示了卵母细胞成熟阶段的一个关键时刻,即卵母细胞转化为成熟卵子,为排卵和可能的受精做准备。在这个阶段,他们观察到ELVA向细胞表面移动,分解其中的蛋白质聚集物,从根本上深度清洁细胞质。这是第一次观察到卵母细胞使用独特的策略来摆脱毒性蛋白聚集物。
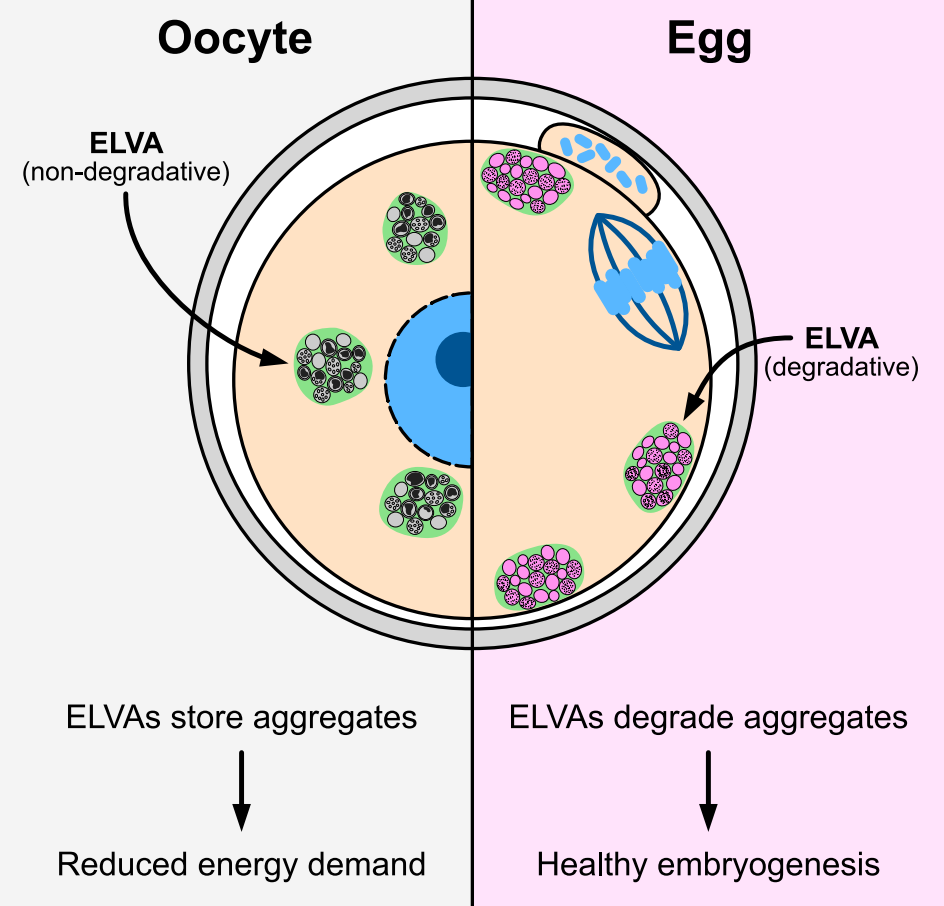
论文第一作者 Gabriele Zaffagnini 博士表示,卵母细胞必须在受精时把所有细胞质留给胚胎,因此它不能容忍对胚胎发育和生存有风险的“垃圾蛋白质”的积累。而ELVA就像一深度清洁团队,它们在卵母细胞的细胞质中巡逻,将蛋白质聚集物保持在一个封闭环境中,直到卵母细胞准备好一次性处理它们,这是一个有效且节能的策略。
这项研究发现,蛋白质聚集物的存在可能干扰卵子和胚胎质量。当研究团队在卵母细胞成熟过程中实验性地阻止ELVA降解蛋白质聚集物的能力时,导致了缺陷卵子的形成。当干预并“强制”胚胎继承这些蛋白质聚集物时,60%的胚胎未能完成非常早期的发育阶段。
论文通讯作者 Elvan Böke 研究员表示,过去的许多研究都集中在卵母细胞质量下降的一个小方面,即减数分裂和整倍性。然而,最近一项对1.1万个胚胎移植的回顾研究表明,女性生育能力随年龄增长而下降还受到其他未知因素的严重影响。这项研究开辟了一个有趣的未来研究方向——探索蛋白质聚集物的降解以及它们在卵母细胞中的调节问题是否可以解释女性年龄相关的生育能力下降问题。


 联系我们
联系我们
 返回
返回