口服多肽类药物生物利用度差,通常需要注射,这降低了患者的依从性,特别是在需要长期治疗的慢性疾病中。口服给药是最方便、患者依从性最高的给药方式,因此,口服多肽制剂的开发一直是研究的热点。自1921年发现口服胰岛素制剂以来,多次尝试开发口服胰岛素制剂均未成功。近年,FDA批准了全球首个GLP-1降糖药Rybelsus(口服司美格鲁肽)上市,这是该领域的一个里程碑,为口服肽疗法的发展注入活力。
口服肽药物开发挑战
口服多肽想要顺利抵达系统循环,需在避免降解的条件下通过肠上皮细胞,然后分泌到淋巴系统或血液中,需要绕过多种结构和功能障碍。
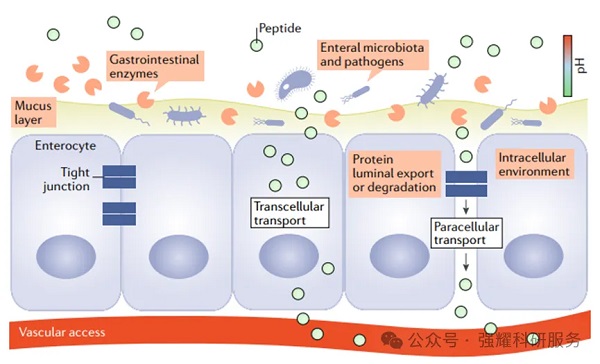
肠道结构和对有效口服肽吸收的相关挑战图,doi: 10.1038/s41573-019-0053-0
1 蛋白酶降解
摄入的多肽制剂首先在唾液中遇到消化酶,包括淀粉酶和脂肪酶。进入胃肠后,在胃肠道内会受到胃酸破坏和酶降解。胃部酸性环境(pH1.2~3.0)和肠碱性环境(pH6.5~8.0)会引起pH诱导的多肽药物氧化、脱酰胺或水解,导致其失活。此外,胃肠道内的多种蛋白水解酶以及刷状缘膜中的蔗糖酶和数十种肽酶,也能导致多肽药物失活。
2. 胃肠黏液层
胃肠道表面有厚厚的黏液层,既是捕获较大分子和病原体的理化屏障,也可以作为润滑剂,促进营养物质吸收。但对于口服多肽药物来说,黏液内分子结构、所带电荷、共价分子数量影响了其扩散和吸收。
3. 细胞旁或跨细胞途径
口服肽药物穿过肠上皮的途径包括:细胞旁途径,穿过细胞周围和细胞间的细胞间隙或跨细胞途径:药物穿过细胞,从而进入邻近肠上皮基底外侧表面的血管间隙。
药物通过细胞旁途径充满挑战性。因为一系列复杂的分子屏障,包括紧密连接、黏性连接和桥粒,这些复合物形成致密的结构以维持上皮结构和完整性。它们只允许水、离子和溶质的必要流动,同时选择性地排除毒素、大分子和微生物。
同样,跨细胞途径也面临着挑战。一些细胞内途径促进多肽药物进入溶酶体途径被降解。口服肽吸收的其他挑战包括,消化道上皮细胞表面缺乏多肽转运受体,多肽直接穿过细胞膜的能力也较差。
4. 个体间的变异性
个体间变异性也是限制口服多肽发展的障碍。
胃肠道生理学:粘液状况,酶的分泌、胃排空和肠道蠕动控制。
胃肠道转运速度:决定上皮暴露于摄取的多肽药物的关键因素,可能受膳食摄入的大小、成分和时间以及年龄的影响。
某些疾病状态下:肠道动力的变化和吸收率的差异与糖尿病胰岛素等治疗药物的开发尤其相关。
解决策略
评估口服肽制剂的适宜性的关键考虑因素:肠粘膜吸收的程度、可检测的药效学活性的实现和全身生物利用度。如果生物利用度太低,生产的药品成本可能过高,商业开发可能不可行。
目前,促进口服肽吸收的多种策略正在被寻求,通常是联合使用,包括纳米颗粒、微针装置、自乳化药物递送系统、肽偶联和渗透增强剂。其中,渗透增强剂是改善口服肽吸收的最广泛测试的方法,因为与纳米技术或基于设备的系统相比,它们相对容易掺入制剂中。
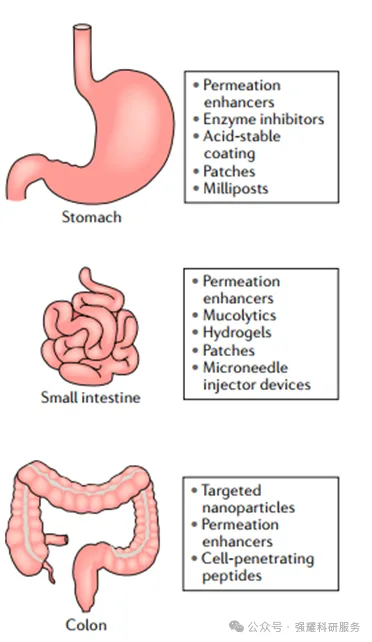
针对胃肠道不同区域促进多肽药物吸收的改进策略图,doi: 10.1038/s41573-019-0053-0
口服多肽药物实例
当前全球成功上市的多肽药物采用了不同的口服策略,主要为:SNEDDS技术,结构优化,促渗剂的使用,以及肠溶技术的使用。
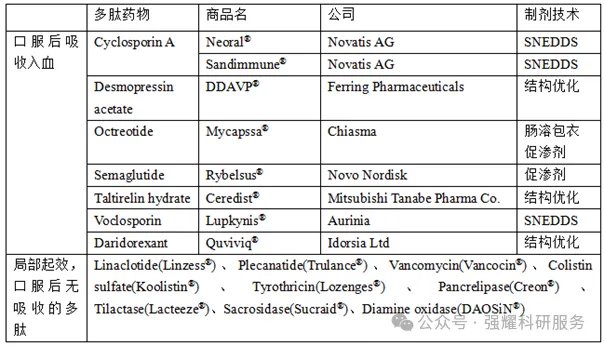
图源于同写意Biotech
SNEDDS技术
环孢素A(CsA)是首个批准上市的口服多肽药物,口服制剂(Sandimmune/Neoral)采用自乳化SNEDDS技术。它是一种免疫抑制剂,用于预防移植排斥反应和治疗自身免疫性疾病。
CsA实现口服制剂的可能原因:环肽结构的天然优势;Me-Leu9和Me-Leu10两个相邻残基之间的酰胺键的构象在其中发挥了微妙但关键的作用。CsA中这个酰胺键的cis/trans构象平衡,其平衡取决于环境的亲水性。由此提出一个假说,CsA会介导由cis到trans构象的转化,前者利于口服吸收,而后者利于与受体的结合。而这恰好满足了口服多肽药物的两个关键条件。
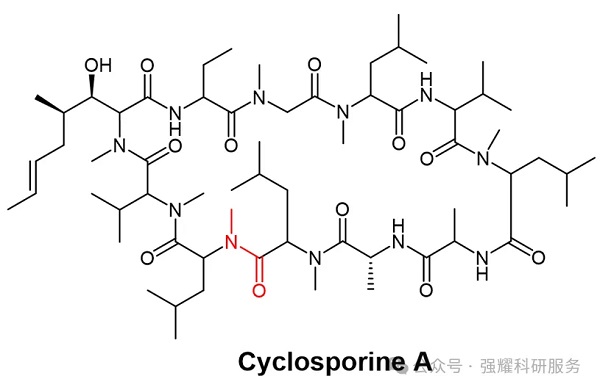
CsA化学结构(红色酰胺键为Me-Leu9-Me-Leu10主链肽键),源于药渡
此外,2022年FDA批准上市的一款口服多肽—Voclosporin(商品名Lupkynis),在CsA的基础上进行结构优化,也使用了SNEDDS技术,口服生物利用度约为8%。Voclosporin是与CsA的化学结构非常相似,唯一不同之处是,用一个乙烯基替换了CsA 1位氨基酸残基侧链的甲基。
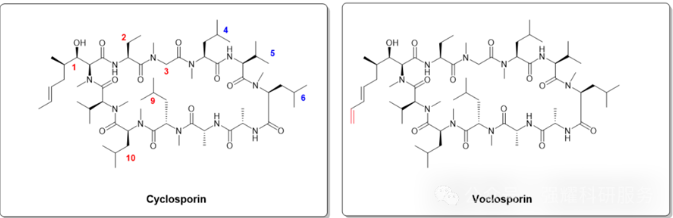
Voclosporin与CsA的化学结构对比图,源于网络
结构优化
醋酸去氨加压素(DDVAP)也是一种环肽,是精氨酸加压素的类似物。其稳定性通过化学修饰得到改善,对第一个氨基酸进行了脱氨,并将第八个氨基酸的L-精氨酸替换为D-精氨酸。DDVAP的口服生物利用度仅为0.1%左右,因为没有使用任何渗透增强技术。
肠溶技术+促渗剂
奥曲肽(Mycapssa)是一种环肽,已在市场上市售口服产品。它是内源性激素生长抑素的合成类似物,由于环状结构,在胃蛋白酶的SGF中具有比生长抑素更高的稳定。2020年6月,FDA批准了通过瞬时通透性增强剂(TPE)技术开发的奥曲肽缓释胶囊。然而,I期和II期临床药代动力学显示口服生物利用度仅为0.5%。TPE技术是一种肠溶衣制剂,可保护药物分子免受消化酶的破坏,并促进肠道分子对肠道内生物利用度有限的药物分子的肠道吸收。
促吸收剂
司美格鲁肽是当前最热门的口服多肽药物,是一种胰高血糖素样肽-1(GLP-1)类似物, 2019年口服片Rybelsus获批上市,用于治疗2型糖尿病。此外,还有另外两种剂型:Ozempic注射剂(针对2型糖尿病)、Wegovy注射剂(用于减重)。Rybelsus,在口服给药后能够保持很长的半衰期。
为延长体内的半衰期,三个关键位置进行了修饰:
1. 用α-氨基异丁酸取代第8位的丙氨酸,使司美格鲁肽不易被二肽酶-4水解;
2. 第26位的赖氨酸上连接了一个C18脂肪二酸侧链,并以谷氨酸作为连接头,增加白蛋白的亲和力,避免药物被肾脏快速清除;
3. 用精氨酸取代第34位的赖氨酸,避免C18脂肪酸链错位结合,提高侧链的稳定性。
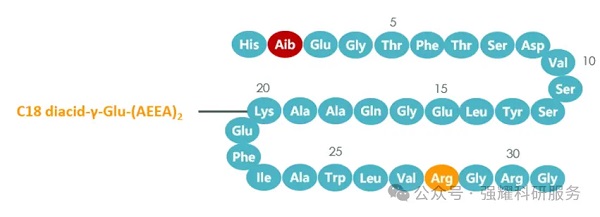
司美格鲁肽结构修饰图,来源于网络
司美格鲁肽口服片的成功,得益于渗透促进剂SNAC(8-(2-羟基苯甲酰胺基)辛酸钠的应用。SNAC与司美格鲁肽简直是天作之合,口服吸收原理如下:
1. 司美格鲁肽片剂在溶解后,SNAC的缓冲效应升高了胃局部pH值,阻止胃蛋白酶对司美格鲁肽的降解,使局部肽浓度升高,借助浓度梯度穿透胃黏膜后吸收;
2. SNAC通过改变片剂溶解的溶液极性来促进司美格鲁肽的单体化,使其渗透性更强;
3. SNAC具有亲脂性,可有效地插入到胃上皮的细胞膜中,改变了胆固醇磷脂和蛋白质固有的完整性,可逆性地促进司美格鲁肽的跨膜吸收;
4. SNAC与司美格鲁肽C18脂肪二酸侧链契合,确保药物分子有效的膜插入及渗透。
借助SNAC独特的吸收促进作用,实现了司美格鲁肽经口服途径给药的历史性跨越,生物利用度提高约100倍。口服片的成功,大大激发了医药工作者的开发口服多肽类药物研究的一大热潮。但是司美格鲁肽片的生物利用度仍然很低。随着对新技术的研究更为深入,期待未来开发出更多的多肽口服制剂,并提高生物利用度。
强耀生物多年来致力于为广大科研工作者提供多肽、蛋白和抗体等一站式服务,以助力您的研究。我们拥有多种肽产品,如司美格鲁肽(仅用于科研研究),如果您有相关需要,请随时联系我们。


 联系我们
联系我们
 返回
返回