血脑屏障(Blood–Brain Barrier,BBB)是大脑实质与外周循环系统间的一道保护性天然屏障,由大脑内皮细胞(bEC)与周细胞、平滑肌细胞、星形胶质细胞、小胶质细胞和巨噬细胞共同组成。血脑屏障允许特定的营养物质从外周循环转运到中枢神经系统(CNS),而阻断不必要或有害物质的进入。病理性因子或全身性炎症对血脑屏障的破坏,可导致或加剧各种中枢神经系统病变,包括阿尔茨海默病(AD)、渐冻症(ALS)、亨廷顿症(HD)和多发性硬化(MS)等。
脂多糖(LPS)是由革兰阴性菌产生的主要促炎分子,可触发血脑屏障破坏。血脑屏障破坏也发生在脓毒症期间,炎症因子和神经毒性物质进入大脑促发脓毒症相关性脑病。然而,尽管已进行了大量研究,感染或炎症条件下血脑屏障破坏的具体机制仍不清楚。
2024年4月17日,北京生命科学研究所/清华大学生物医学交叉研究院邵峰团队与北京脑科学与类脑研究所罗敏敏团队合作,在 Nature 期刊发表了题为:Brain endothelial GSDMD activation mediates inflammatory BBB breakdown研究论文。
该研究阐释了血脑屏障炎症性破坏的机制——革兰氏阴性菌感染或脂多糖(LPS)刺激下,激活脑内皮细胞中的caspase-4/11-GSDMD信号通路,从而导致血脑屏障的炎症性破坏。
这一发现不仅为理解血脑屏障在炎症状态下的破坏机制提供了新视角,还提出了与血脑屏障损伤相关的中枢神经系统疾病的潜在治疗方法。

LPS会被细胞膜上的TLR4-MD2复合物识别,这种识别导致许多促炎细胞因子的转录诱导,这些细胞因子被认为是LPS诱导的炎症的原因。有研究表明,脂多糖刺激后血脑屏障的破坏可能是由于TLR4依赖的蛋白质调节所致,这些蛋白质参与维持血脑屏障的完整性,例如紧密连接或粘附连接蛋白。
LPS还会在细胞质中被小鼠caspase-11和人类caspase-4和caspase-5识别,通过诱导细胞焦亡(Pyroptosis)刺激炎症。LPS激活的caspase-4/5和11切割打孔蛋白GSDMD,释放其GSDMD-N结构域,穿透质膜释放细胞内炎性因子和/或引起细胞焦亡。Caspase-11/GSDMD细胞焦亡信号通路的过度激活是LPS诱导小鼠脓毒症的重要原因。Casepase-11/GSDMD这类非经典炎症小体(inflammasome)主要在巨噬细胞中被发现和研究,但最近的研究表明,非经典炎性小体的激活和焦亡也发生在上皮细胞和其他非免疫细胞中。
在这项研究中,研究团队发现,细胞质中的LPS受体caspase-11激活了打孔蛋白GSDMD(而非TLR4诱导的转录调控)在循环系统LPS刺激或者细菌感染引起的脓毒症中介导了血脑屏障的破坏。LBP或者CD14缺陷小鼠不能响应LPS引起的血脑屏障的破坏,提示LBP和CD14可能参与了LPS的转运和内吞。单细胞RNA测序分析表明,脑内皮细胞表达GSDMD并对循环系统中的LPS有显著反应。LPS作用于bEC启动Casp11和Cd14基因表达并诱导GSDMD介导的质膜通透性和细胞焦亡。电镜下可见BBB损伤后的超微结构改变,包括内皮细胞焦亡、紧密连接异常、血管脱离基底膜等。
综合小鼠遗传学分析,结合靶向bEC的腺相关病毒(AAV)系统,研究团队证实了bEC中GSDMD的激活是LPS破坏血脑屏障的基础。将有活性的GSDMD递送到bEC,绕过LPS刺激,能够打开血脑屏障。在CASP4人源化小鼠模型中,革兰阴性菌肺炎克雷伯菌感染会破坏血脑屏障,而这一破坏作用可以通过在bEC中表达GSDMD中和纳米抗体来阻断。
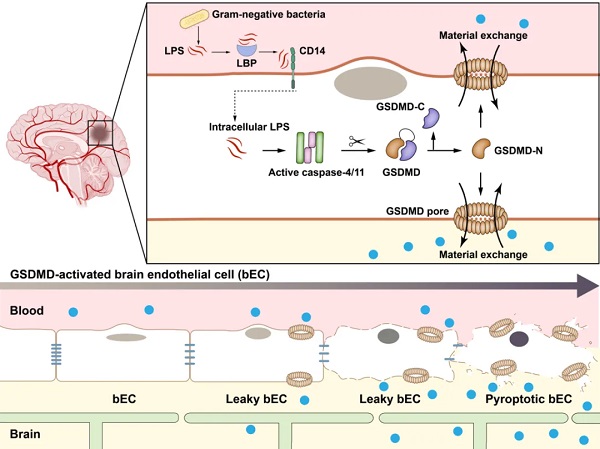
脑内皮细胞GSDMD激活的分子机制(图片由邵峰实验室绘制)
总的来说,该研究阐明了脂多糖(LPS)或者革兰氏阴性菌感染导致的血脑屏障破坏的分子和细胞生物学机制,进一步提供了GSDMD基因参与非免疫细胞重要生理过程的新证据。以GSDMD为靶点来设计激动型或者抑制型药物,可能成为有效调控血脑屏障通透性的新策略,为解决跨血脑屏障递送药物开辟了新思路,也为治疗中枢神经系统(CNS)疾病提供了新的潜在治疗方法。
北京脑科学与类脑研究所罗敏敏实验室副研究员韦超博士和北京生命科学研究所邵峰实验室博士后蒋唯博士为论文共同第一作者。罗敏敏实验室博士后王睿宇博士完成了该研究的单细胞RNA测序与分析的工作,对论文有重大贡献。罗敏敏博士和邵峰博士为该论文的共同通讯作者。


 联系我们
联系我们
 返回
返回