近期,山东第二医科大学生物科学与技术学院白靖琨团队连续发表了3篇关于抗肿瘤肽的研究。研究团队通过开发PH响应的载药两亲性肽,自组装成球形纳米粒,并在酸性环境中转化为高长径比聚集体,延长了药物保留时间,增强抗肿瘤效果。三篇研究的题目分别为:
1. Targeted drug-loaded peptides induce tumor cell apoptosis and immunomodulation to increase antitumor efficacy(IF 7.9);
2. pH-responsive self-assembling peptides potentiate therapeutic efficacy via prolonged drug retention and immunomodulation(IF 8.4);
3. pH-Triggered Transformable Peptide Nanocarriers Extend Drug Retention for Breast Cancer Combination Therapy(IF 10)。
乳腺癌(BC)是目前世界上最常见的癌症之一,也是女性癌症相关死亡的主要原因。BC的治疗主要依靠化疗,然而药物外排阻碍治疗药物在BC部位的充分积累。此外,许多化疗药物存在缺陷,如缺乏肿瘤细胞特异性、溶解性差和显著的毒副作用。
纳米载体系统为克服癌症治疗中的瓶颈提供了新的机会。球形纳米颗粒(NPs)有利于药物的细胞内化,而高纵横比聚集体可以更有效地被细胞保留。通过经历形态变化(如形成高纵横比聚集体)对特定条件(如与肿瘤细胞中过度表达的酶相互作用,实体肿瘤的微酸性细胞外环境pH 6.5等)做出反应的纳米载体可以在体内积累并长期保留。这种现象称为高渗透长滞留效应(EPR效应)。因此,使用载药NPs可以增加化疗剂在肿瘤部位的积累。然而载体材料的生物相容性、代谢和潜在毒性仍需彻底研究。
肿瘤微环境具有独特的属性,包括酸性pH值、缺氧、异常酶表达和免疫抑制环境,与癌症进展、转移和治疗结果密切相关。智能纳米载体平台可以选择性地响应肿瘤微环境中的信号,已经成功设计并广泛应用于癌症诊断和治疗。两亲性小分子肽作为载体具有独特的优势,例如优异的生物适应性、通过自组装进行转化的能力以及易于修饰。且小分子肽易于修饰,纳米载体的主动靶向能力可以通过用肽进行表面修饰来有效提高。
基于此,白靖琨博士课题组的三篇研究均开发了一种通过靶向肽修饰的pH响应性两亲肽,包裹化疗药物并在体外自组装成球形纳米颗粒。然后在低pH条件下,酸性肿瘤微环境诱导肽-药物纳米颗粒转化为具有高纵横比的聚集体,实现了化疗药物的长期保留。三篇研究的不同之处在于:靶向肽、联合不同化疗药物治疗、和分别针对BC、BC及免疫治疗、BC干细胞。
1. 靶向载药肽诱导肿瘤细胞凋亡和免疫调节以增强抗肿瘤疗效
靶向肽:D8肽(DMPGTVLP),对乳腺癌细胞的高选择性和特异性。使用肽D8进行表面修饰可以有效提高纳米载体的主动靶向能力。
化疗药物:多柔比星(DOX),具有广泛抗肿瘤活性和引发免疫原性细胞死亡的能力。雷公藤内酯醇(TPL),与抗癌药物联合使用时表现出协同作用,且不会加重化疗的副作用。
联合化疗治疗:临床数据表明,在患有晚期转移性BC的个体中,联合化疗治疗在生存率、肿瘤反应和进展时间方面产生了显著的益处。
Pep1:含有天冬氨酸和D8肽靶向序列的两亲性肽
Pep2:不含D8序列的两亲性肽
基于以上背景,该篇研究开发了一种pH响应性D8肽修饰的基于肽的纳米药物递送系统DT/Pep1。在酸性环境中DT/Pep1纳米球可以转化为具有高纵横比的聚集体,因此实现了药物的长期保留。DOX和TPL作用于DNA,阻断细胞周期并导致DNA损伤。在DOX存在的情况下,肿瘤细胞发生免疫原性细胞死亡(ICD),HMGB-1被释放到细胞外空间,最终引发免疫反应,导致肿瘤细胞死亡。
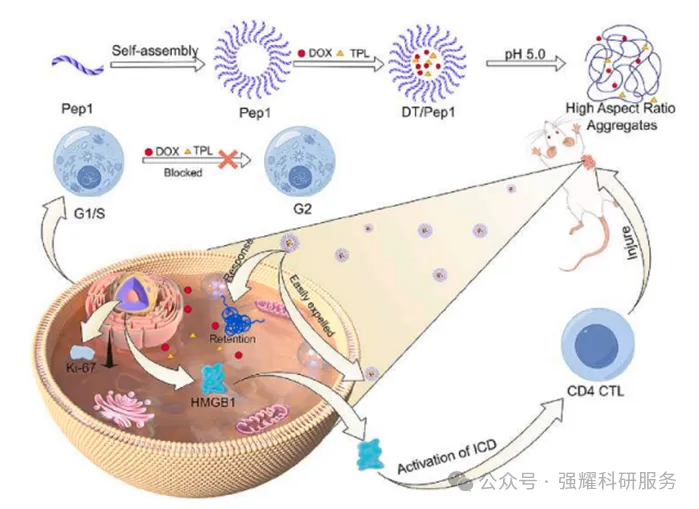
用于BC治疗的pH响应性活性靶向纳米系统DT/Pep1的示意图
体内和体外实验结果表明,DT/Pep1组合不仅降低了对主要器官的毒性,而且抗肿瘤效果优于两种药物的简单混合物,显著改善了肿瘤免疫微环境。因此,这项研究的结果证明了基于对酸性条件响应的肿瘤药物递送策略的有效性,该策略可以很容易地进行修饰以携带其他药物或药剂。DT/Pep1系统也是治疗BC的有效且安全的疗法。
2. pH响应性自组装肽通过延长药物滞留和免疫调节增强疗效
靶向肽:PHSCN,一种通过α5β1受体发挥作用的靶向肽,已被证明可抑制BC的进展。
化疗药物:多柔比星(DOX),诱导肿瘤细胞DNA损伤,溶解性差和心脏毒性限制了其应用。二甲双胍(MET),改善肿瘤缺氧,作为免疫佐剂降低PD-L1水平,从而增强T细胞介导的抗肿瘤免疫。MET的亲水性在其膜渗透性、快速清除和短半衰期方面提出了挑战。
联合化疗治疗:当MET与化疗药物联合使用时,会出现协同抗肿瘤作用。因此,联合应用MET和化疗药物DOX有可能成为乳腺癌的治疗策略。MET的特点是其带正电荷的氨基,这有助于其通过静电吸引与带负电荷的肽相互作用。
Pep1:含有天冬氨酸和PHSCN肽序列
Pep2:含有赖氨酸而没有PHSCN肽序列
因此,为了提高BC化疗和免疫治疗的疗效,研究团队构建了一种pH响应性PHSCN修饰的多肽纳米给药系统DM/Pep1。DM/Pep1纳米颗粒通过EPR效应和主动靶向α5β1被BC细胞摄取。在低pH条件下,酸性肿瘤微环境诱导肽-药物纳米颗粒转化为具有高纵横比的聚集体,释放出DOX和MET。随后,DOX诱导ICD消除肿瘤细胞(化疗),MET下调PD-L1促进T细胞介导的抗肿瘤作用(免疫治疗)。
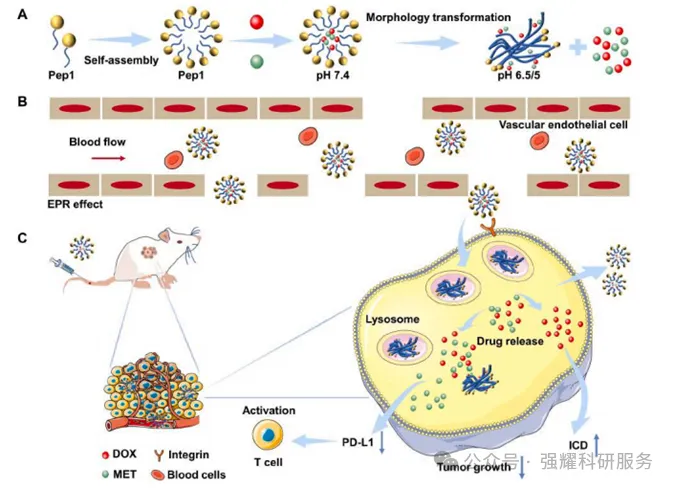
用于BC治疗的pH响应性活性靶向纳米系统DM/Pep1的示意图
体外实验结果表明,DM/Pep1纳米载体延长了药物在BC细胞内的滞留时间,并抑制了肿瘤细胞的迁移。体内抗肿瘤实验进一步证实了这种载体系统的治疗益处。DM/Pep1纳米载体利用DOX的化学特性和MET的免疫调节作用的协同效应,诱导ICD、上调CD4和下调PD-L1,从而调节抗肿瘤免疫反应。该研究表明,这种响应性纳米制剂有望成为BC治疗的多功能平台,提供化疗和免疫调节相结合的双重机制。
3. PH触发的可转化多肽纳米载体延长乳腺癌联合治疗的药物保留时间
靶向肽:酸性成纤维细胞生长因子(aFGF)结合肽(AGNWTPI),靶向在乳腺癌中高度表达的aFGF。
化疗药物:顺式二氨基氯铂(DDP),广谱的铂类化疗药物。它与DNA结合,导致DNA交联,破坏DNA功能,抑制细胞有丝分裂。DDP治疗诱导的耐药性可能导致癌症干细胞(CSCs)的出现。CSC富集可反过来导致肿瘤细胞中的DDP耐药性。因此,CSCs的治疗迫在眉睫。
全反式维甲酸(ATRA),减轻DDP引起的肾毒性,减少DDP对睾丸的损伤。并显著改善顺铂化疗引起的周围神经病变。ATRA已被证明可以诱导BC中的CSCs分化。
联合化疗治疗:当ATRA与DDP联合使用时,可以增加肿瘤对DDP的敏感性,抑制DDP的耐药性,并增加DDP治疗的有效性。而ATRA的低血浆浓度、高全身副作用和理化不稳定性,以及缺乏有效的给药系统,限制了其临床应用,这些缺点迫切需要解决。
Pep1:含有天冬氨酸残基和靶向aFGF的AGNWTPI序列。
Pep2:包含赖氨酸残基和AGTP序列。
因此,研究小组设计了一种pH响应性多肽药物载体系统DA/Pep1。
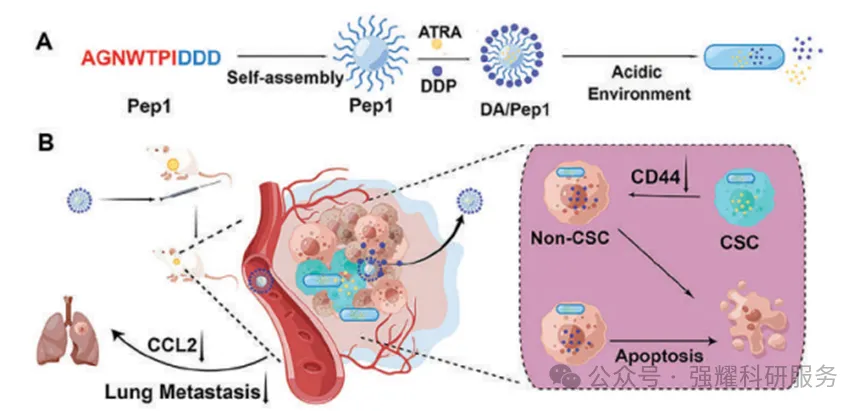
用于CSC治疗的pH响应性活性靶向纳米系统DA/Pep1的示意图
抗肿瘤药物DDP可以通过形成羧基-药物相互作用而被包封在Pep1中,而促分化药物ATRA由于其脂溶性可以被包封在疏水核中。在酸性微环境中DA/Pep1会发生结构转变,转化为含有片状结构的聚集体,显著延长了药物在肿瘤部位的保留时间。DA/Pep1诱导CSCs分化为非CSCs并诱导肿瘤细胞凋亡。最终,DA/Pep1抑制肿瘤生长,从而抑制肺转移。这种纳米载体系统在肿瘤治疗中具有巨大的潜力,为肿瘤及其转移的治疗提供了新的方向。
三篇研究中的Pep1和Pep2肽均由强耀生物提供。


 联系我们
联系我们
 返回
返回