研究背景
循环肿瘤细胞(CTC)从原发性肿瘤脱离出来进入血液,在癌症转移中起着关键作用,是癌症诊断的关键生物标志物。然而,血液中CTC丰度低,检测困难。为了克服这一障碍,各种技术如微流控芯片,纳米结构细胞捕获基底和免疫磁性分离,在CTCs富集方面取得了显著的成功。而基于磁性颗粒的免疫磁性分离,因其易于操作、快速磁响应和高回收效率而广受欢迎。从纳米颗粒到微米大小的磁珠等各种大小的磁性颗粒已被研究人员用于快速细胞分离和检测。
虽然这些方法前景可观,但并非没有局限性。首先,广泛使用的靶向配体依赖于癌症特异性相互作用,通常使用体积大、价格昂贵且易于失活的抗体。这激发了对更具成本效益且易于获得的靶向分子的研究,肽因其尺寸小、稳定且易于功能化而成为一种有前途的替代品。其次,在这些方法中通常被忽略的问题涉及捕获细胞的释放,这是下游分析的一个重要步骤。实现CTCs释放而不损害其完整性需要开发动态生物界面。研究人员在之前的工作中使用贻贝启发的肽和可逆的儿茶酚硼酸盐化学,构建了这种生物界面,用于癌细胞的捕获和释放。第三,在CTCs磁分离的背景下,颗粒大小对捕获和释放效率的影响缺乏共识。磁性微球因其快速的磁响应和低损失率而广受青睐,在该领域占据主导地位。相反,磁性纳米颗粒具有较弱的磁响应,但提供了较大的比表面积,从而增强了与CTCs的相互作用。然而,在相同的实验条件下,很少有研究颗粒大小影响的报道。对于从根本上了解不同尺寸磁性颗粒的适用条件来说,此类研究至关重要。
鉴于此,镇江市第一人民医院肿瘤科秦蓉医生联合江苏大学新材料研究院刘磊研究员团队,构建了一种动态生物界面磁性微粒(DBMPs),结合靶向具有上皮生物标志物的癌细胞的特异性肽,用于CTCs的捕获和释放,重点是颗粒大小对其性能的影响。构建这种生物界面的一个关键因素是磁性颗粒上的聚多巴胺(PDA)涂层。PDA不仅改善了生物相容性,还通过与可逆儿茶酚-硼酸酯相互作用,锚定苯基硼酸(PBA)修饰的生物活性多肽。在儿茶酚-PBA复合体中,儿茶酚-PBA键的动态性质允许通过分子交换机制引入果糖来释放捕获的细胞。此外,以牛血清白蛋白(BSA)作为封闭剂,共价连接到PDA层,最大限度地减少了非特异性吸附,并显著降低了材料的细胞毒性。
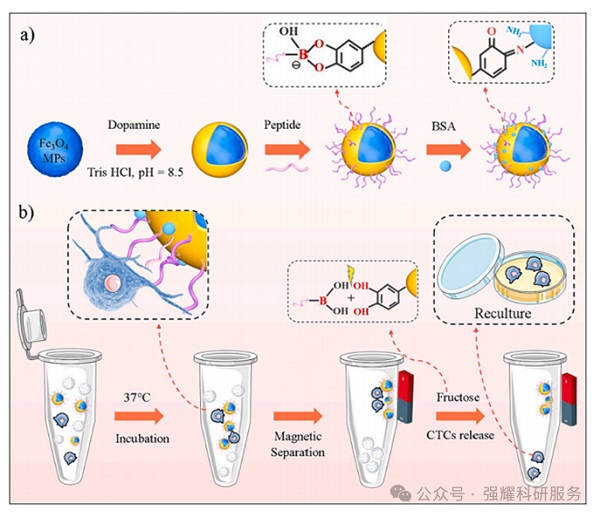
DBMP制备以及肿瘤细胞捕获和释放示意图
结果表明,磁性颗粒的大小对捕获和释放效率都有影响。较小的颗粒在捕获CTCs方面表现出较高的效率,而较大的颗粒表现出更高的释放效率。这些发现为优化CTCs分离策略和提高释放过程中捕获细胞的生存能力开辟了新的途径,最终提供了一个在临床实践和肿瘤学研究中具有多种应用的通用平台。
研究结果
1
DBMP1,2,3的制备和表征
研究团队采用三种不同尺寸的Fe3O4-1,2,3颗粒制备DBMPs。
SEM图像和相应的粒度分布显示,Fe3O4-1,2,3的平均尺寸分别为200 nm、3.5 μm和50 μm。

Fe3O4-1、2、3的SEM图像及粒度分布图
首先通过TGA和XPS分析来证实PDA的成功覆盖:
经PDA修饰前后:(1)有机组分增加,其中Fe3O4-3由于其较低的比表面积有机组分的显著降低;(2)表面元素也发生变化,Fe原子百分率显著降低,而C和N原子百分率显著增加;此外,O1s、N1s和C1s电子结合能发生明显变化。
表明了PDA在Fe3O4表面的有效覆盖,以及覆盖后表面化学发生变化。
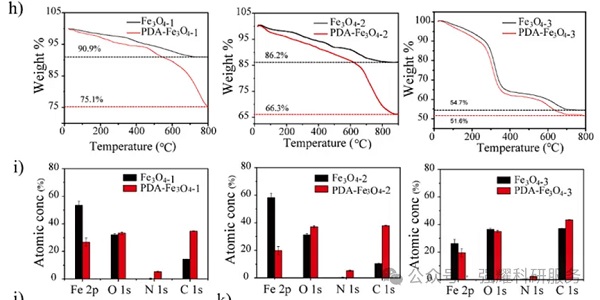
TGA和XPS分析图
耗散型石英晶体微天平(QCM-D),一种高灵敏度的表界面技术,用来评价生物医用高分子材料的表界面相互作用,力学和生物相容性等。
然后用QCM-D验证了肽捕获剂PBA-(PEG)8-X(X=WxEAAYQrFL,x=D-Nle,r=D-Arg)和阻断剂BSA与PDA的结合:
PBA-(PEG)8-X加入后,共振频率急剧下降,表明肽通过儿茶酚与PBA之间的动态共价键与PDA快速结合;注射果糖后,果糖和PDA的结合与PDA修饰的肽竞争,导致肽从PDA表面移位,频率增加;加入BSA后,频率进一步降低,可能是由于醌基团和亲核试剂(胺)的共价偶联。这些结果证实了PBA-(PEG)8-X和BSA在PDA-Fe3O4-1,2,3上的成功接枝。
进一步地,为了公平比较细胞捕获效率,研究者设计的3种DBMP接枝等量的肽和BSA,且DBMP1、2、3对细胞存活率无显著影响,细胞存活率均超过96%。
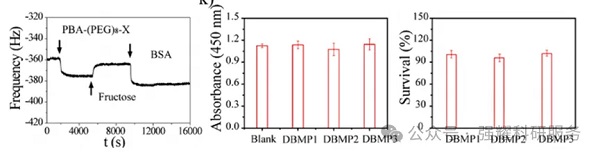
实时QCM-D频移以及三种DBMPs孵育MCF-7的细胞活力和存活率图
2
捕获和释放CTCs
人乳腺癌肿瘤细胞:MCF-7细胞,
人早幼粒细胞急性白血病细胞:HL60细胞
相同条件下,DBMP1、2和3的捕获效率差异显著,分别为89.9%、74.8%和27.1%。表明了较小颗粒的比表面积更高,前两者比DBMP3与癌细胞相互作用的可能性更高。
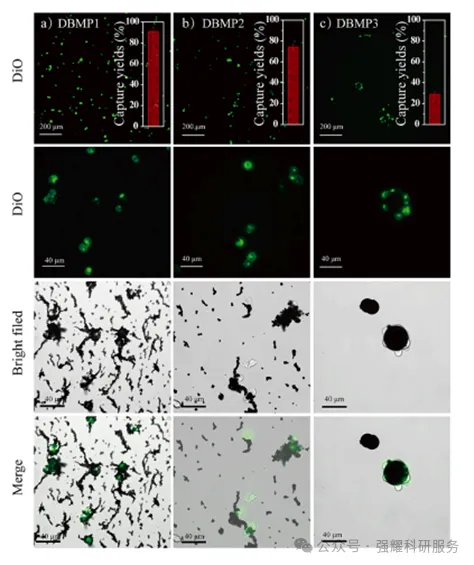
DBMP1,2,3捕获癌细胞的荧光和细节图像
在复杂基质中评估对上皮生物标志物CTC的捕获特异性。即使有大量HL 60细胞的干扰,DBMP1、2、3也能选择性地富集MCF-7细胞,且富集后的MCF-7细胞纯度均达到90%以上。在减少DBMP1、2、3和细胞靶向肽的非特异性粘附方面,防污分子BSA发挥了至关重要的作用,显著增强了细胞的识别和捕获能力。
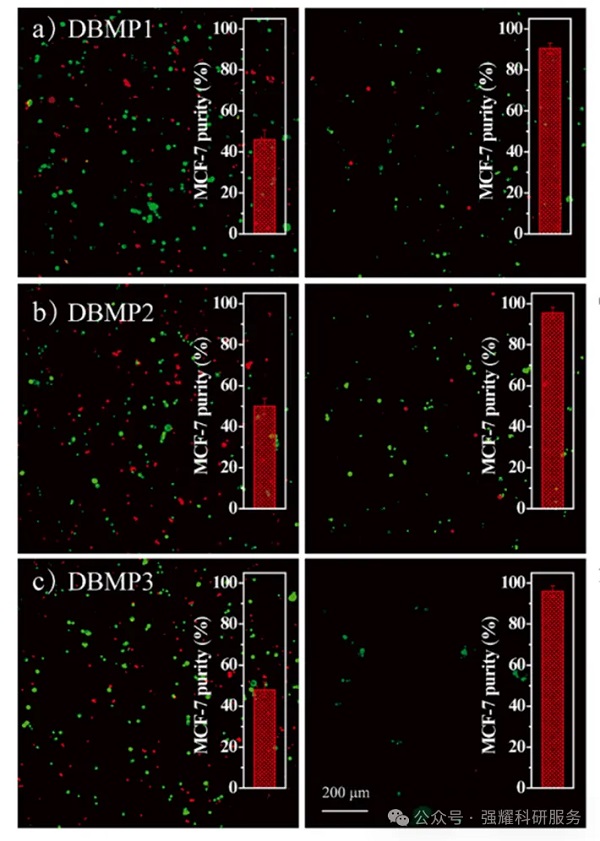
三种DBMPs的选择性细胞捕获图
然后为研究DBMP捕获血液样本中CTCs的能力,研究人员将MCF-7注射到新鲜绵羊血液中,以代表癌症患者的模拟血液样本。结果显示,DBMP1、2、3捕获效率分别为65%、55%和35%。表明了在模拟癌症患者的血液样本中,DBMP可以有效地捕获罕见的癌细胞,在临床中具有一定的实用性和可靠性。

癌症患者的模拟血液样本中DBMPs的CTCs捕获能力图
然而经糖处理后,DBMP1、2释放效率低于58%,DBMP3却表现出高达89%的高释放效率,尽管其捕获效率较低。释放效率的差异可归因于颗粒和细胞之间不同的相互作用模式。对于深入细胞和分子水平的CTCs分析,快速有效地释放捕获的CTCs而不损害细胞显得尤为重要。因此,下一步的重点是进一步优化DBMP3。

DBMPs上MCF-7细胞释放图
3
DBMP3的优化
首先优化了生物活性肽和BSA在DBMP3表面的接枝量,当肽浓度为150 μg/mL和BSA浓度1.5%时,接枝量达到饱和。
然后优化了DBMP3的浓度,当其浓度为1000 μg/mL时,DBMP3对MCF-7细胞的捕获效率最高,为63%。在含有果糖的培养基中,DBMP3上捕获的MCF-7细胞约92%在孵育30 min后被释放。
最后评估了释放细胞的活性。经过1、3和5 d的培养,MCF-7细胞对果糖的反应释放的活性与原始未经处理的细胞相当。
这些结果表明,肿瘤细胞可以被非侵入性地操纵,并且释放的MCF-7细胞在长期培养过程中保持了增殖能力。
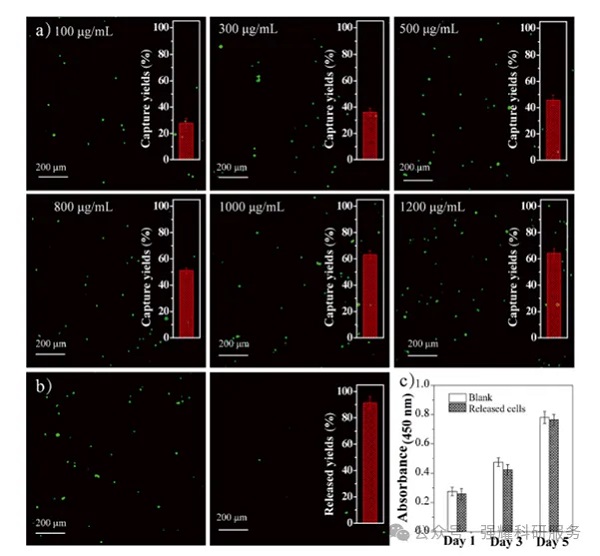
DBMP3优化的捕获性能以及细胞释放性能、释放后细胞活性
综上,该篇研究揭示了通过可逆儿茶酚-硼酸盐与癌症靶向肽相互作用,DBMPs可以捕获和释放CTC的潜力。这些多功能磁性颗粒,从纳米级到更大的微米级颗粒,为研究人员和临床医生提供了量身定制的选择,优化了CTC的分离策略。值得注意的是,虽然较小的颗粒(DBMP1和2)在高效捕获CTC方面表现出色,但较大的颗粒(DBMP3)表现出更高的释放效率,保留了捕获细胞的活力。DBMPs的高生物相容性,特别是优化后的DBMP3,对于保持CTC的完整性、促进下游分析和潜在的临床应用至关重要。研究团队认为,这篇研究不仅推动了CTC分离技术的进步,而且为癌症研究和临床实践提供了一个多样化的应用平台,有望造福癌症患者,为肿瘤学领域做出贡献。
本篇研究中的PBA-(PEG)8-X(X=WxEAAYQrFL,x=D-Nle,r=D-Arg)由强耀生物提供。


 联系我们
联系我们
 返回
返回