多肽是一类在生物体内扮演重要角色的分子,因其低毒性、低免疫原性、高组织渗透性和易合成修饰等优点,被广泛应用于药物递送和疾病治疗。然而,多肽易被多种蛋白酶分解,清除速率高,这导致其体内代谢快、稳定性差、半衰期短,从而给多肽相关药物的研发与应用带来了挑战。本文旨在对提高多肽体内稳定性的策略进行简单总结,以期为多肽的应用提供参考。
多肽之所以在生物体内稳定性差、半衰期短,一方面与其特殊的分子结构紧密相关。多肽主链上位于分子表面的酰胺基团容易发生蛋白酶催化和非酶催化的脱酰胺反应,链上的氨基酸残基也容易发生构象变化,例如α-螺旋的解离和盐桥的断裂等。另一方面,多肽的分子尺寸相对较小,因此容易被肾脏从血液中滤除。为了提高多肽在体内的稳定性,可以通过降低多肽结构中参与降解反应的活泼性,以增强其稳定性,或者增加多肽的分子量,以避免被清除。具体的优化策略可以从以下几个方面进行:
1、N-端和C-端修饰:防外肽酶降解
将多肽的N-端和C-端进行结构改造,可以躲避氨肽酶和羧肽酶的识别,是保护多肽免于蛋白酶降解的有效策略。
从N端或C端对肽链进行一定程度的延长,可以增强静电作用,进而提高多肽的稳定性。且若沿着肽链骨架在N端或C端延长一定长度的对热较稳定或对酶不敏感的氨基酸序列,则能在一定程度上抑制氨肽酶和羧肽酶从N端或C端的降解。此外,甲基化、N端乙酰化、C端酰胺化等修饰也可以防止外肽酶的酶解。
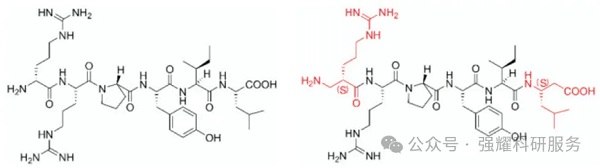
神经降压素末端修饰
2、氨基酸替换:降低与蛋白酶亲和力
2.1 D-型氨基酸
蛋白酶的水解反应一般都是立体专一的。引入D-型氨基酸会使多肽的构型发生变化,进而使得修饰的多肽不易被蛋白水解酶水解。可用的方法有用D-型氨基酸替代多肽链的C端和N端的氨基酸,或替换肽键稳定性差的氨基酸残基,或替代所有氨基酸。当多肽为特殊序列不能替换时,可将其与D-型肽相连以改善肽的蛋白酶稳定性。
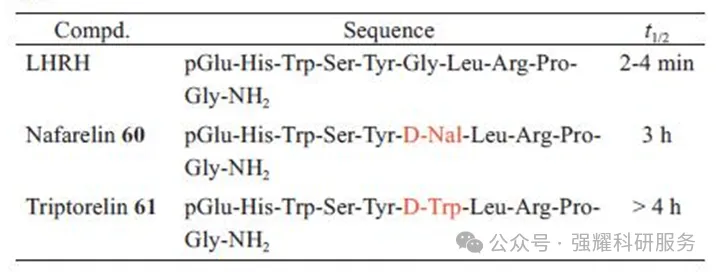
黄体激素释放激素(LHRH)引入D-型氨基酸
2.2 人造氨基酸
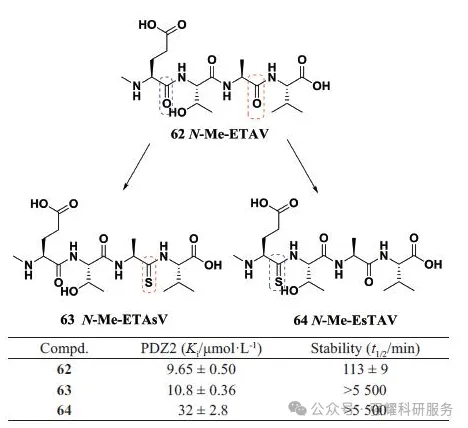
β-和γ-氨基酸以及其他非天然氨基酸的替代。以β-氨基酸为例,它可改变多肽整体的构象,原本蛋白酶切割中心的水分子无法与酰胺键形成氢键,不利于蛋白酶对酰胺键的切割,因而具有更强的抗水解能力。
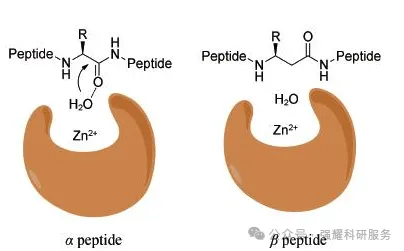
β氨基酸抗水解
2.3 改变单个或多个氨基酸
多肽链主链与主链之间、侧链与侧链之间主要靠静电作用维系结构稳定。可以通过替换掉其中几个氨基酸来增强多肽链之间的静电作用。此外,多肽的选择性氟化也可提高化学和热稳定性,同时增强疏水性。多肽糖基化也是一种较为理想的稳定多肽类的方式。
3、改变肽键:避免蛋白酶识别水解
3.1 伪肽化
肽键(-CONH-)是肽类分子的特征,而肽键在体内容易被蛋白酶识别降解。伪肽则是将肽键中的一种或两种以上的原子用其他原子替代,从本质上改变了酰胺键的化学结构,与蛋白或多肽同源结构不同,因此可以避免体内蛋白酶的识别和水解,从而提高肽类分子的稳定性及活性。
伪肽键
3.2 逆肽化
肽键方向的改变同样可以改变蛋白酶对底物的识别作用,从而达到抗降解的作用。这类改变肽键方向的多肽结构修饰策略称为逆肽化修饰,相关的肽称为逆肽或逆反肽。
4、环化或双环化:提高化合物刚性
4.1 多肽环化
与直链肽相比,多肽环化降低了肽链的灵活性,保护其不受肽链端解酶的影响,因此环肽具有更好的结构稳定性。环化可以利用酰胺键、二硫键、内酯键、醚键、硫醚键、烯烃、氨基甲酸酯键等方式让多肽首尾相连、首与侧链相连,尾与侧链相连以及侧链之间连接等,其中常用的是酰胺键和二硫键。
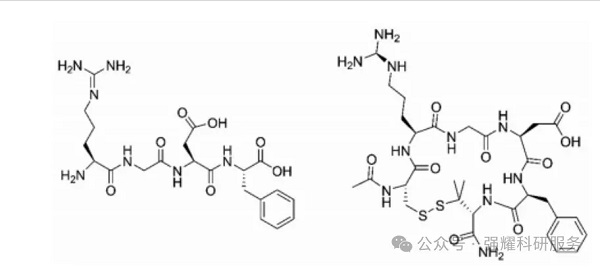
形成环肽
4.2 订书肽
大部分多肽片段在离开蛋白质整体结构后将无法稳定形成结合所需的二级结构,而易于形成无规则卷曲构象,从而导致结合活性下降,并且更易受肽酶的降解,无法直接成药。应用全碳骨架或其他连接链形成侧链环合结构改造多肽来稳定α-螺旋肽的活性构象,即订书肽(stapled peptide)。目前,钌催化的烯烃复分解是较为成熟形成订书肽的方法。订书肽是提高稳定性、稳定螺旋结构很好的选择,但是据文献报道其毒性也是不可忽视的。
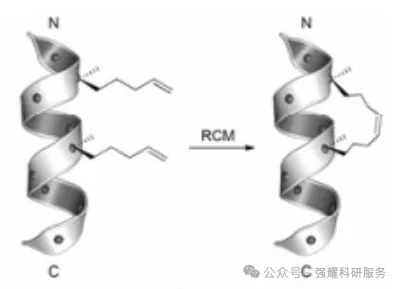
订书肽
4.3 二聚体构建
利用多肽分子内或分子间的二硫键、α-螺旋和疏水缔合作用等形成α-螺旋二聚体,这种结构不仅能够将多肽维持在α-螺旋构象,而且可以调节疏水相互作用,还可将易被蛋白酶识别的位点放于内侧。
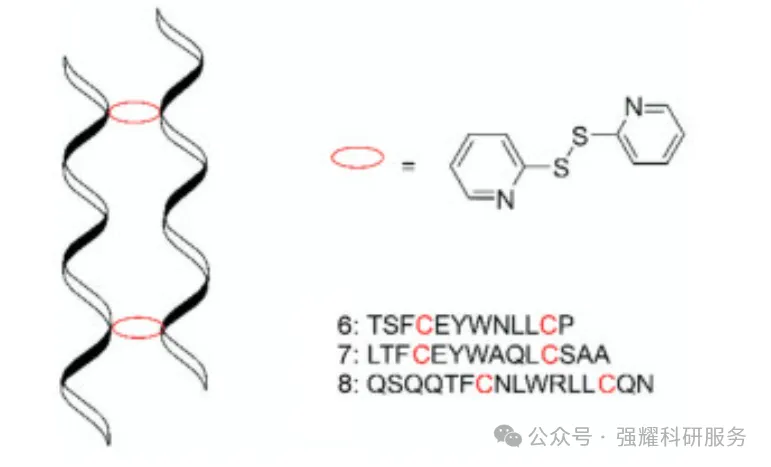
二聚体
5、增加分子量:避免肾快速代谢
5.1 高级脂肪酸修饰
肽类的特定位点通过化学方法以共价键的形式引入高级脂肪酸链。此外,引入脂肪链可通过增加疏水作用以增强多肽的结构稳定性。研究表明,脂肪链可以促进多肽衍生物与血清白蛋白非共价结合,结合后的复合体因分子过大而不容易转运,从而可以延长多肽在体内的循环时间。
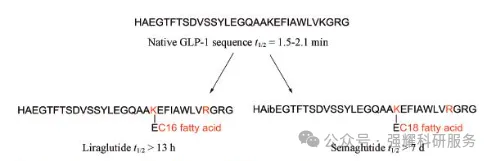
高级脂肪酸修饰肽
5.2 聚乙二醇(PEG)修饰
PEG具有高水溶性、低毒性、无免疫原性且易从体内清除的特点。末端利用PEG修饰可保护氨基酸残基、显著增加分子量和空间位阻,因此可以改善肽类分子的稳定性、增强溶解性、减少蛋白酶的降解、不易被肾小球滤过,从而延长多肽的半衰期。
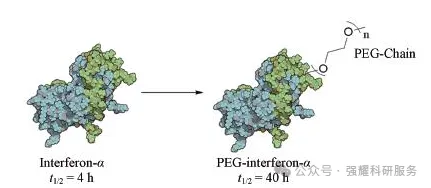
PEG修饰干扰素α
除PEG外,还有由N-(2-羟丙基)甲基丙烯酰胺(HPMA)和N-(3-氨基丙基)甲基丙烯酰胺(APMA)组成的聚合物。Ngambenjawong等利用该聚合物延长了巨噬细胞靶向肽(M2pep)的稳定性。
6、蛋白融合:延长半衰期
与其他蛋白质相比,血浆中的白蛋白和免疫球蛋白G的半衰期相对较长。利用基因工程技术,将多肽分子与免疫球蛋白Fc片段或血清白蛋白HSA融合。融合Fc或HSA片段之后的多肽分子,分子尺寸显著增大,降低了肾对多肽的清除率,从而延长多肽的半衰期。
7、物理包埋:形成屏障保护
除了对多肽本身进行修饰外,还可以使用高分子物质包裹多肽,形成屏障保护多肽免于蛋白酶切割。常用的包埋方法有纳米粒、脂质体、微球、微乳等。此外,有研究人员利用自组装活性的疏水蛋白将多肽包裹在腔内,从而防止其被蛋白酶降解。
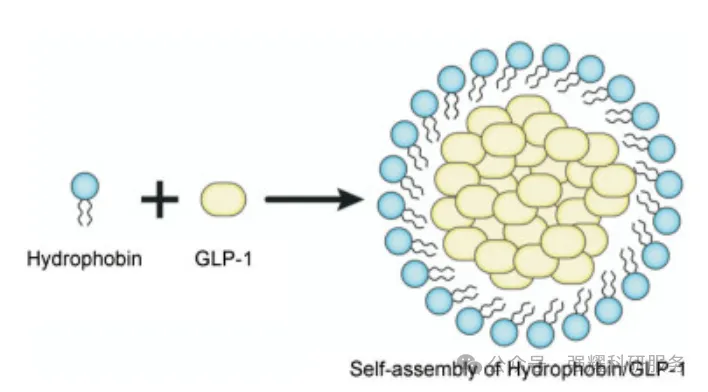
疏水蛋白包裹GLP-1
8、多种方法联合使用
联合使用多种方法对多肽进行改造,在增强多肽的稳定性的同时,还可增强细胞结合能力、抗肿瘤能力以及克服血脑屏障等能力。
多肽作为治疗分子和药物/基因载体,因其不稳定性,在多个领域的许多应用受到限制。尽管对多肽结构改造以提高稳定性取得了一定的进展,但仍面临合成难度大、可能影响生物活性等挑战。未来的研究需要在提高稳定性的同时,兼顾多肽的生理活性。因此,根据每种肽的特点,选择合适的改造或修饰方法可能是目前比较可靠、理想的策略。
3.1 伪肽化


 联系我们
联系我们
 返回
返回