向蛋白降解(TPD)是一种通过细胞内蛋白回收机制选择性降解目标蛋白的方法,对传统药物无法有效靶向的“不可成药”蛋白具有巨大潜力。然而,现有的TPD工具设计复杂,需要针对不同疾病和细胞类型进行个案设计,尤其是对于细胞外靶点,严重阻碍了临床的转化。
近日,河南大学脑靶向生物纳米药物重点实验室的研究团队发现抗体、多肽修饰的纳米颗粒在细胞运输过程中自发地会启动靶向蛋白降解,基于此提出了一种通用策略,利用纳米颗粒(NPs)介导特定受体独立的内吞作用,结合临床批准的成分,实现细胞外蛋白的高效降解。
该项研究发表在《Nature Nanotechnology》上,题为“Targeted protein degradation via cellular trafficking ofnanoparticles“。
1、研究方法
研究人员设计并合成了抗体或肽修饰的纳米颗粒(TPD-NPs),利用聚乙二醇-二硬脂酰基磷脂酰乙醇胺(PEG-DSPE)作为连接剂。通过自组装方法制备了PLGA核心的聚合物-脂质杂化纳米颗粒,并在其表面修饰抗体或肽。
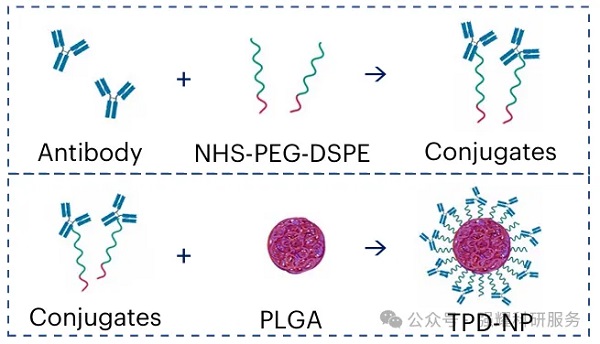
抗体介导的TPD-NP结构的示意图
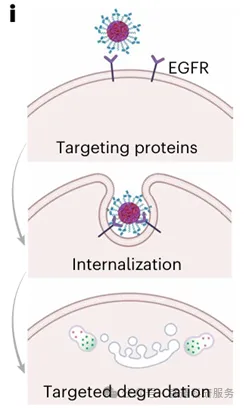
使用TPD-NPs降解EGFR的示意图
随后,他们在多种细胞系中评估了TPD-NPs的蛋白降解效果,包括EGFR、PD-1、PD-L1、HER2等靶点。
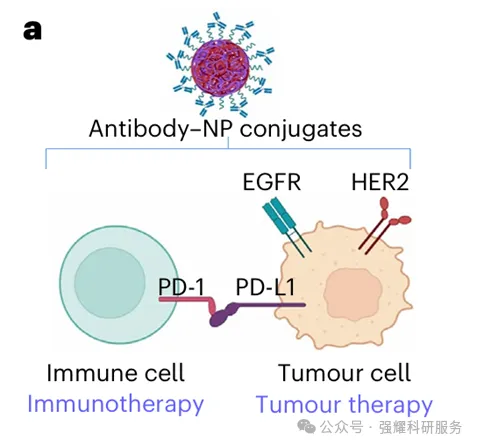
代表性的POIs示意图以及为TPD评估配制的抗体-NP偶联物
接着,通过抑制剂实验和基因敲除实验验证了蛋白降解机制,确认了自噬溶酶体途径的关键作用。
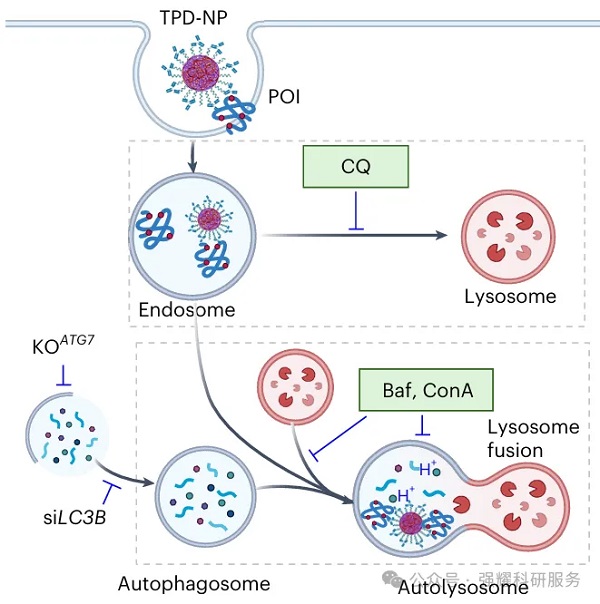
TPD-NPs的非细胞质蛋白降解途径示意图
注:CQ(氯喹),Baf(巴佛霉素A1)、ConA(刀豆球蛋白A)为自噬抑制剂,siLC3B为抑制自噬相关蛋白LC3B蛋白表达的siRNA,KOATG7为敲除自噬关键蛋白ATGT的细胞。
最后,在小鼠肿瘤模型中评估了TPD-NPs的体内性能,包括肿瘤生长抑制和生物安全性。
在带有皮下移植MDA-MB-231肿瘤的动物模型中评估EGFR降解的治疗时间表
2、研究结果
研究表明,利用纳米颗粒介导的细胞内吞作用可以有效地降解细胞外蛋白,为TPD工具的发展提供了新的范式。具体来说,这种通用且灵活的TPD-NPs策略避免了现有TPD工具的复杂设计要求。在多种细胞系和体内模型中,TPD-NPs表现出优异的蛋白降解效果,显著抑制了肿瘤生长。实验设计全面,涵盖了从体外到体内的多个层面,验证了方法的有效性和安全性。
3、应用前景
这项研究不仅为TPD工具的发展提供了新的范式,还拓宽了纳米医学的应用范围。TPD-NPs策略的通用性和灵活性使其在癌症治疗、免疫疗法和抗感染等领域具有广泛的应用潜力。未来,研究人员将进一步优化TPD-NPs的设计,提高其在临床应用中的安全性和有效性。


 联系我们
联系我们
 返回
返回