帕金森病(Parkinson's Disease, PD)是一种常见的神经退行性疾病,其病理特征之一是α-突触核蛋白(α-synuclein, α-syn)纤维在大脑中的异常聚集和传播。然而,这种纤维如何被细胞摄取并驱动疾病进展的具体机制一直未被完全揭示。
近期的一项研究揭示帕金森病(Parkinson's Disease, PD)中病理性的α-突触核蛋白(α-synuclein, α-syn)纤维聚集和传播的机制,并表明 FAM171A2在这种病理过程中的关键作用及其潜在的治疗意义。
该项研究发表在《Science》,题为“Neuronal FAM171A2 mediates a-synuclein fibril uptake and drives Parkinson’s disease”
1、α-syn纤维受体FAM171A2
研究表明,FAM171A2是一种能够与α-syn纤维结合的潜在受体。它通过促进α-syn纤维的内吞作用,加剧了这些纤维的病理传播及其对神经元的毒性影响。具体来说,FAM171A2不仅识别α-syn纤维,还通过细胞内的内吞途径将其摄入细胞内部。这一过程可能进一步导致α-syn纤维在神经网络中的扩散,从而加速帕金森病的进程。
2、研究方法与发现
为了验证FAM171A2在α-syn纤维摄取中的作用,研究人员采用了多种实验技术。通过生化分析、细胞实验以及动物模型实验,确认了FAM171A2与α-syn纤维之间的相互作用,并揭示了这种相互作用的具体位点。此外,研究还发现了一种小分子药物bemcentinib,可以有效阻断FAM171A2与α-syn纤维的结合,从而抑制α-syn纤维的内吞和传播。
具体的实验设计如下:
(1)相关性分析
通过对帕金森病(PD)中脑组织研究,FAM171A2 表达升高与患者的 α-突触核蛋白(α-syn)有病理相关性。
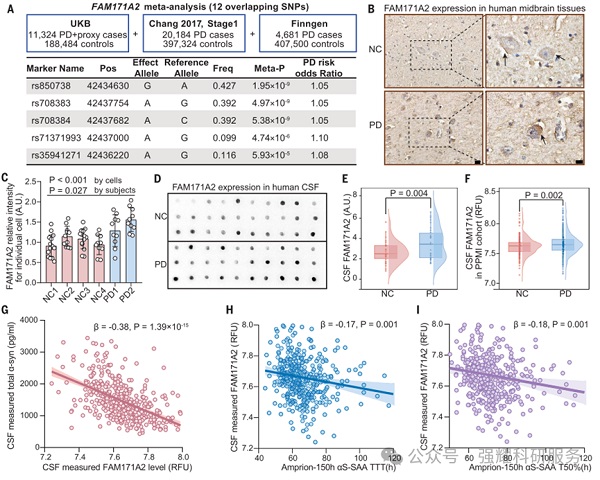
图1.相关性研究
(2)表型证实
通过动物实验,利用小鼠模型评估FAM171A2在体内对α-syn病理传播和神经毒性的调控作用。
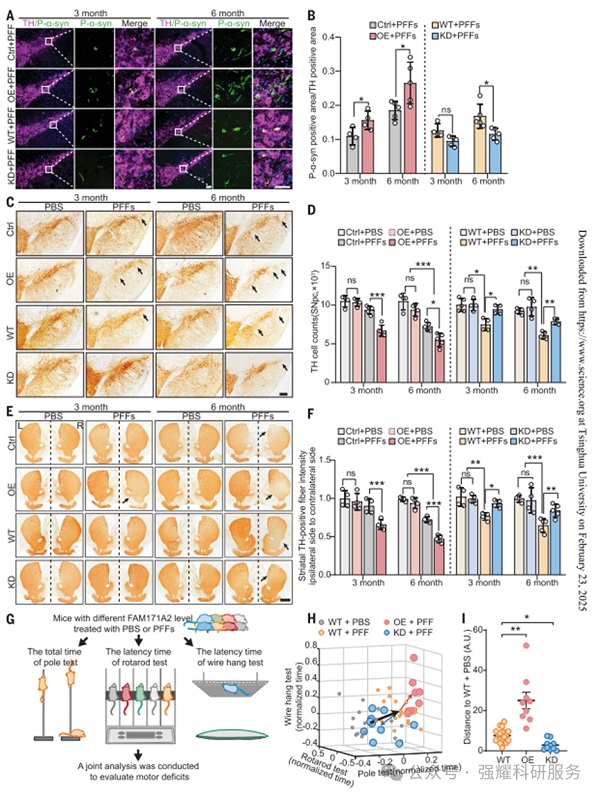
图2.表型证实
(3)表型背后的细胞与分子机制
通过细胞实验的免疫荧光和Western blot验证FAM171A2对α-syn纤维内吞的调控作用,并且验证了FAM171A2 与 α-突触核蛋白 (α-syn) 纤维直接相互作用和具体位点。
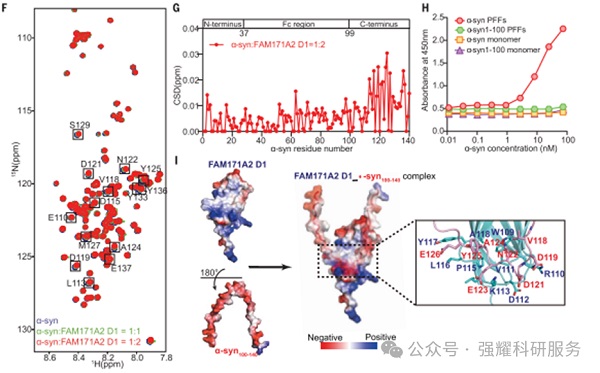
图3.分子机制
(4)药物筛选与验证
筛选出bemcentinib药物可以有效阻断FAM171A2与α-syn纤维的结合,从而抑制α-syn纤维的内吞和传播,进一步证明FAM171A2作为潜在治疗靶点的重要性。
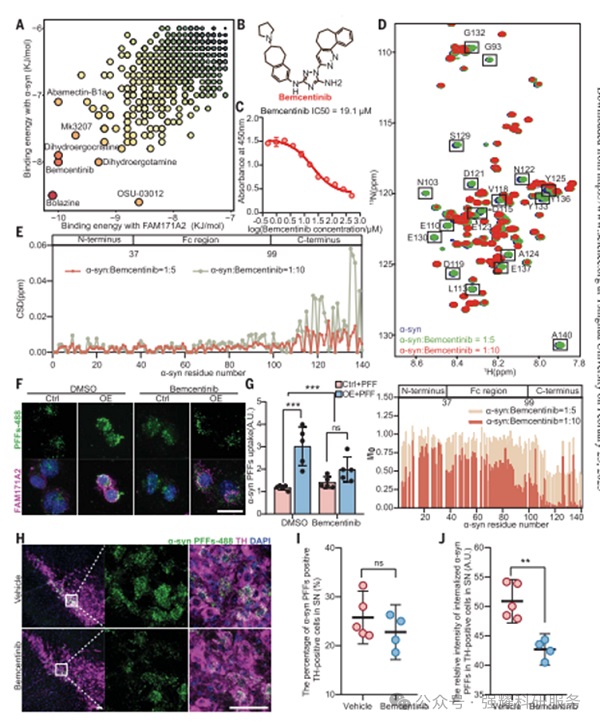
图4.药物验证
3、小分子药物的应用前景
bemcentinib作为一种潜在的治疗药物,展示了抑制α-syn纤维传播的可能性。通过阻断FAM171A2与α-syn纤维的结合,bemcentinib可能成为一种新型的治疗策略,用于减缓或阻止帕金森病的进展。这为未来开发针对α-syn纤维传播的治疗方法提供了重要的理论基础和实验依据。
4、未来展望
这项研究不仅加深了我们对帕金森病中α-syn纤维传播机制的理解,还为开发新的治疗策略提供了潜在靶点。FAM171A2作为α-syn纤维的潜在受体,其在病理传播中的作用值得进一步研究。同时,bemcentinib的成功应用也为药物研发领域带来了新的希望。
强耀生物可提供重组人α-突触核蛋白(α-syn)相关产品助力科研!


 联系我们
联系我们
 返回
返回