1、背景与目标
近年来,原位癌症疫苗(ISCVs)因其能够利用自体肿瘤抗原激发全身抗肿瘤免疫反应而备受关注。然而,肿瘤细胞的低免疫原性限制了ISCVs的疗效。为解决这一问题,郑州大学张开翔团队开发了一种名为PRIZE的P53修复纳米系统。该系统通过递送p53 mRNA和Zn(II),恢复肿瘤细胞中WT P53水平,增强其免疫原性,从而显著提升ISCVs的效果。
该研究发表在《ADVANCED SCIENCE》,题为“Restoring Tumor Cell Immunogenicity Through Ion-Assisted p53 mRNA Domestication for Enhanced In Situ Cancer Vaccination Effect”
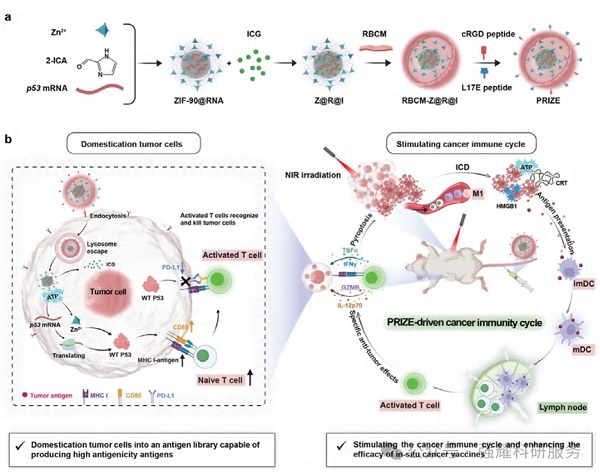
P53恢复纳米系统的合成与表征
2、实验设计与机制
1.PRIZE的设计与功能
PRIZE基于病毒模拟纳米结构设计,核心由装载p53 mRNA和光热剂ICG的ZIF-90纳米颗粒组成,外层包裹红细胞膜(RBCM),并利用DSPE作为连接基团,修饰靶向肽cRGD和溶酶体逃逸肽L17E。这种设计确保了p53 mRNA的精确递送、稳定性和延长的半衰期,同时实现了Zn(II)对WT P53蛋白结构稳定性的维持。
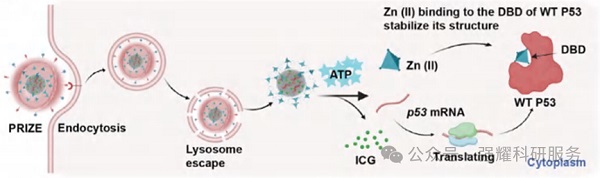
PRIZE在肿瘤细胞内的示意图
2.修复P53异常与增强免疫原性
在4T1(P53缺乏型)和MC38(P53突变型)细胞中,PRIZE有效修复了P53异常,上调MHC I类分子和共刺激分子CD80的表达,增强了抗原呈递能力,将肿瘤细胞转化为原位抗原库。
共递送的光热剂ICG在激光照射下触发免疫原性细胞死亡(ICD),释放肿瘤相关抗原,诱导ISCVs形成,并激活树突状细胞(DCs)成熟与迁移至淋巴结,建立全身抗肿瘤免疫反应的正反馈循环,启动癌症免疫周期(CIC)。
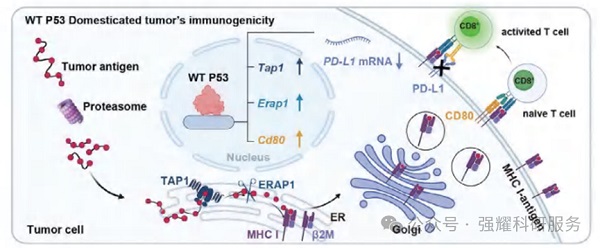
WT P53驯化肿瘤细胞成为高免疫原性抗原库的示意图
3.体内实验验证
在P53异常的小鼠肿瘤模型中,PRIZE诱导的ISCVs显著激活了CIC,产生强大的免疫记忆,抑制肿瘤转移和术后复发。
PRIZE+NIR治疗显著提高了小鼠的生存率,特别是在MC38结肠癌模型中,60天内的存活率提高到60%,证明了其强大的抗肿瘤功效。
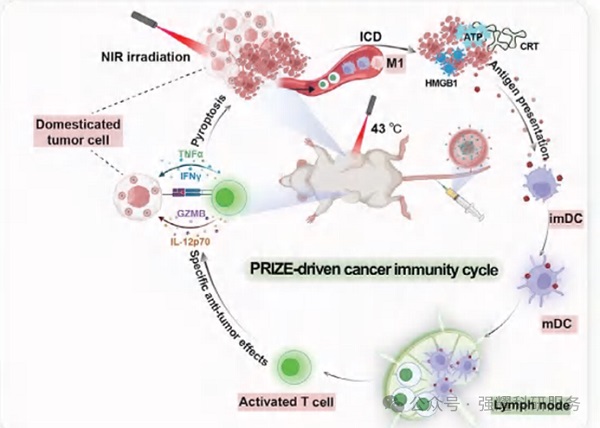
光热疗法协同PRIZE驯化激活CIC并增强ISCV疗效的示意图
3.关键发现与意义
免疫记忆效应:PRIZE+NIR治疗后的小鼠在重新接种肿瘤细胞时,能够完全抑制肿瘤再生长,表明该策略成功训练了免疫系统以对抗肿瘤复发。
临床转化潜力:通过修复P53异常来增强肿瘤细胞免疫原性,为加速ISCVs的临床转化提供了有希望的方法,无需为每位患者定制个性化疫苗。
4.结论
本研究提出了一种创新策略,通过修复P53异常增强肿瘤细胞的免疫原性,为ISCVs的疗效提升提供了新思路。这一成果不仅深化了对P53在肿瘤免疫中的作用的理解,也为未来开发高效、普适的癌症治疗方法奠定了基础。
该研究中DSPE-PGE2000-L17E由强耀生物合成


 联系我们
联系我们
 返回
返回