2025年,福建闽江大学的研究团队在Materials & Design发表题为“Aβ aggregation inhibition via peptide-conjugated gold nanoclusters”的研究论文,该项工作中设计了一种新型肽修饰的金纳米簇AuCRHA1,实现了Aβ聚集的高效抑制与毒性逆转,为阿尔茨海默病(AD)治疗提供了新策略。
主要创新点:
(1)合成一种与肽CRHRHKLVFF功能化的新型金纳米簇(AuCRHA1);
(2)名为AuCRHA1的纳米簇显示出抑制Aβ聚集的显著能力;
(3)阐明AuCRHA1的抑制机制:与游离Aβ单体结合,以降低有效Aβ浓度和解聚成熟原纤维;
(4)AuCRHA1在AD模型中有效降低Aβ的细胞毒性并延长秀丽隐杆线虫的寿命。
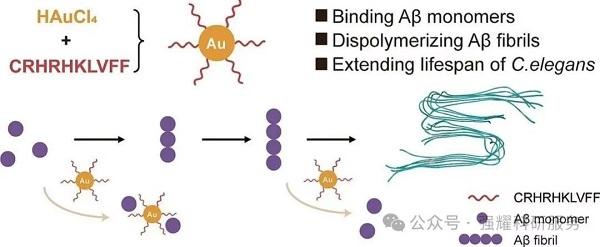
图1. 图形摘要
一、研究背景
阿尔茨海默病
阿尔茨海默病(Alzheimer's disease,AD)的病理核心是淀粉样蛋白β(amyloid β-protein, Aβ)的异常聚集,其形成的寡聚体和纤维对神经元具有毒性作用,推动了以Aβ为靶点的治疗策略开发。尽管FDA近年批准了Aduhelm等抗Aβ抗体药物,但高昂的治疗成本和淀粉样蛋白相关影像异常等副作用限制了临床应用。因此,开发高特异性、低毒性的Aβ聚集抑制剂成为领域关键挑战。
金纳米簇
金纳米簇AuNCs因尺寸小于3nm、具有肾脏清除能力和良好的生物相容性,在Aβ聚集调控中展现独特优势。然而,现有AuNCs多通过非特异性静电作用与Aβ结合,缺乏靶向识别基序,在复杂生物环境中易失活。本研究聚焦于如何通过肽段修饰赋予AuNCs对Aβ的特异性识别能力,并解析其抑制Aβ聚集的分子机制,为AD治疗提供新策略。
二、关键科学问题
1. AuCRHA1如何实现对Aβ的特异性识别?
AuCRHA1通过共轭肽段CRHRHKLVFF实现对Aβ的特异性识别。该肽段包含 KLVFF motif,与Aβ的核心聚集区域(如LVFF)具有序列互补性,可通过静电相互作用和π-π堆积作用特异性结合Aβ。此外,肽段中引入的带正电荷His和Arg残基增强了与带负电荷Aβ的静电结合,进一步提高了特异性。
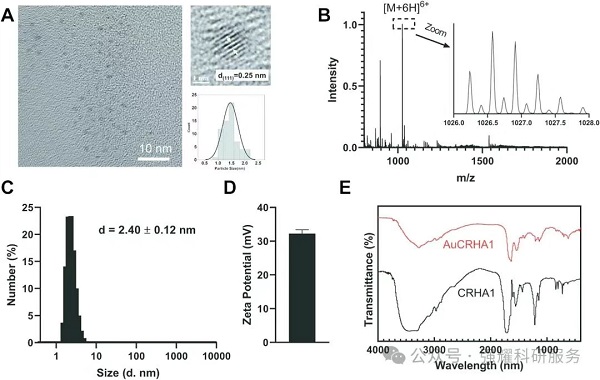
图2. AuCRHA1表征
2. AuCRHA1抑制Aβ聚集的主要机制是什么?
AuCRHA1通过双重机制抑制Aβ聚集:
(1)结合游离Aβ单体:通过ITC测定,AuCRHA1与Aβ40单体的解离常数 KD=627±171nM,结合比为3:4,可降低游离单体的有效浓度,抑制初级成核和纤维延伸。AuCRHA1主要通过与游离 Aβ 结合来发挥其抑制作用40单体,从而降低可用于Aβ 的单体的有效浓度40集合体。
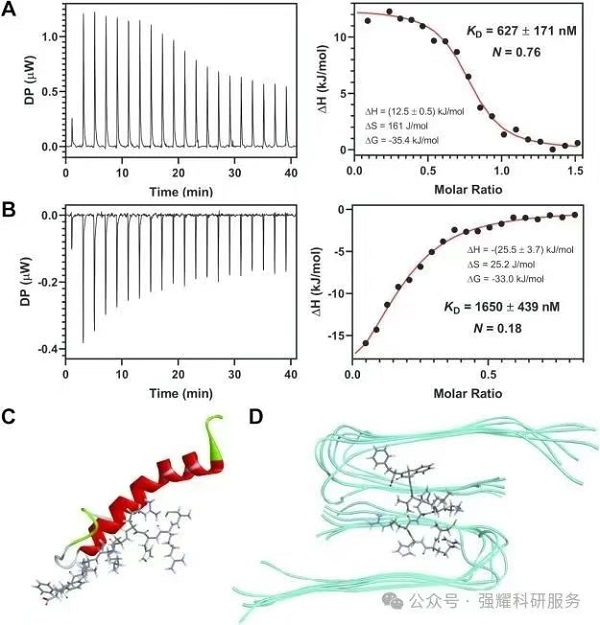
图3. AuNCs结合Aβ单体
(2)解聚成熟纤维:与Aβ40纤维的KD=1650±439 nM,通过破坏纤维的β-折叠结构,促进纤维解聚为较小聚集体。化学动力学分析表明,高浓度下(如5μg/mL),单体结合为主要抑制方式(占55%)。
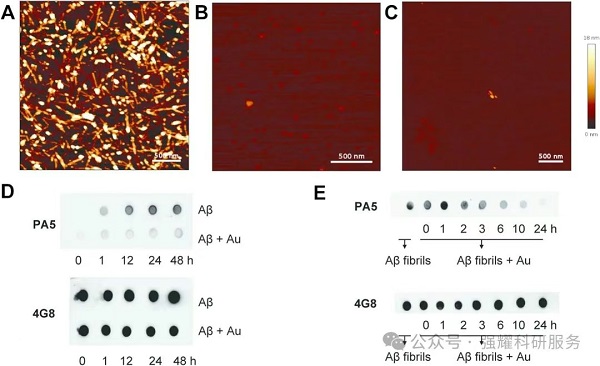
图4. AuCRHA1抑制Aβ聚集
3. AuCRHA1在AD模型中的体内效果如何?
在AD模型秀丽隐杆线虫(CL4176)中,AuCRHA1表现出显著的体内抗AD效果:
(1)延长寿命:10μg/mL AuCRHA1使线虫中位寿命从18天延长至22天,最大寿命从22天延长至26天;50μg/mL时最大寿命可延长至38天。
(2)减少斑块沉积:50μg/mL AuCRHA1处理 CL2006 线虫48h后,Aβ斑块沉积显著减少,通过ThT染色观察到斑块数量接近野生型N2线虫水平,表明其在体内可有效抑制Aβ聚集和沉积。
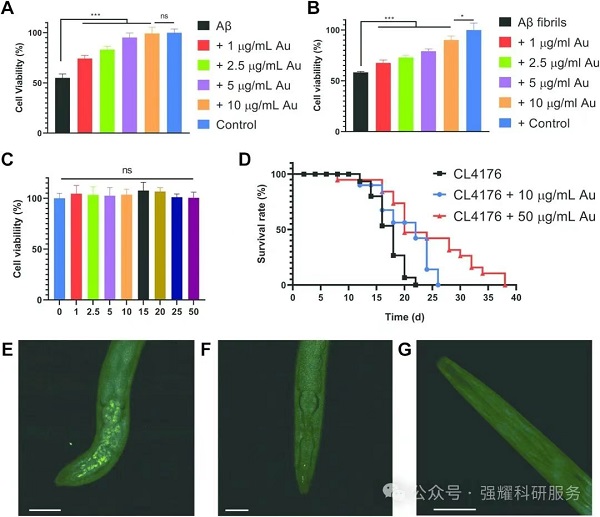
图5. AuCRHA1降低Aβ细胞毒性
三、总结与展望
本研究成功设计并表征了肽共轭金纳米簇AuCRHA1,其通过KLVFF基序实现对Aβ的特异性识别,兼具抑制聚集和解聚纤维的双重功能,在细胞和线虫模型中展现显著疗效。研究揭示的 “结合单体-解聚纤维” 双机制,为Aβ靶向治疗提供了新的理论基础。
未来研究可聚焦于:①优化纳米簇结构以提高血脑屏障穿透率;②开展非人灵长类动物实验验证安全性和有效性;③探索AuCRHA1与其他AD治疗策略(如抗炎药物)的联合应用潜力。这一工作为AD的纳米药物开发开辟了新路径,有望推动安全、经济的抗AD疗法临床转化。
本研究中Aβ40, Aβ42, CR, CKHKH, CKLVFF, CEDEDKLVFF, CRHRHKLVFF多肽均由强耀生物合成;强耀生物提供多肽合成,蛋白和抗体制备等优秀服务助力科研


 联系我们
联系我们
 返回
返回