循环肿瘤细胞(CTC)的检测已成为恶性肿瘤早期诊断、治疗监测和预后的一种有前途的方法。南京医科大学第一附属医院检验医学部团队在Sensors and Actuators B: Chemical 发表题为“Optimized multifunctional peptide based magnetic biointerface for selective capture and sensitive detection of circulating tumor cells in breast cancer”论文。这项研究中成功构建的MPMB平台,通过PDA涂层修饰磁性纳米颗粒,嫁接双靶向肽(EpCAM和HER2)及BSA抗污层,实现了对乳腺癌CTCs的高效、特异捕获。
主要创新点
(1)设计开发了一种基于多功能肽的磁性生物界面(MPMB);
(2)MPMB显示出分离不同类型乳腺肿瘤细胞的能力,捕获效率高;
(3)MPMB在诊断晚期TNM分期和远处转移等方面具有临床验证和诊断潜力。
一、研究背景
循环肿瘤细胞(CTCs)是从原发肿瘤脱落,并通过血液或淋巴系统扩散的细胞,在癌症转移和进展中起关键作用,作为液体活检的核心组分,在肿瘤早期检测、疗效评估和预后判断中至关重要。然而,由于CTCs具有异质性且极为罕见,在大量血细胞中检测这类稀有细胞面临巨大挑战。
现有CTCs分离富集技术主要分为:
a. 物理方法:依赖CTCs与其他血细胞的大小、电荷差异,但存在假阳性率高、分离效率低的局限;
b. 亲和力方法:利用CTCs膜表面特定蛋白,通过抗体、适配体或肽的靶向作用分离枚举,但多数依赖单一表面标志物,难以应对CTCs异质性问题。
传统以EpCAM为唯一标志物的捕获方法,因CTCs转移过程中上皮-间质转化(EMT)导致EpCAM表达下调,易出现假阴性;而HER2在约60%乳腺癌患者中表达,且HER2阳性CTCs在原发肿瘤HER2阴性患者中也可检测到,故联合EpCAM与HER2作为标志物有望提升检测灵敏度和准确性。
二、研究目的
针对现有CTCs检测技术的局限性,本研究旨在开发一种基于多功能肽的磁性生物界面(MPMB)平台,以磁性纳米颗粒(MP)为基础,通过表面修饰双识别肽(靶向EpCAM和HER2)及抗污剂牛血清白蛋白(BSA),实现对乳腺癌CTCs的高效、特异捕获与检测,为乳腺癌患者的疗效监测和预后评估提供简单、灵活且高效的工具。
三、主要研究成果
1. MPMB平台的构建与表征
(1)平台构建:通过聚多巴胺(PDA)涂层修饰磁性纳米颗粒,依次嫁接靶向EpCAM(PBA-(PEG)₈-Z,Z=VRRDAPRFSMQGLDACGGNNCNN)和HER2(NH₂-S-S-(PEG)₈-X,X=GRQLFDNPDQALLDTANDG )的双识别肽,及抗污剂BSA,形成多功能磁性生物界面(MPMB),实现对乳腺癌CTCs的特异性捕获(示意图见Fig1)。
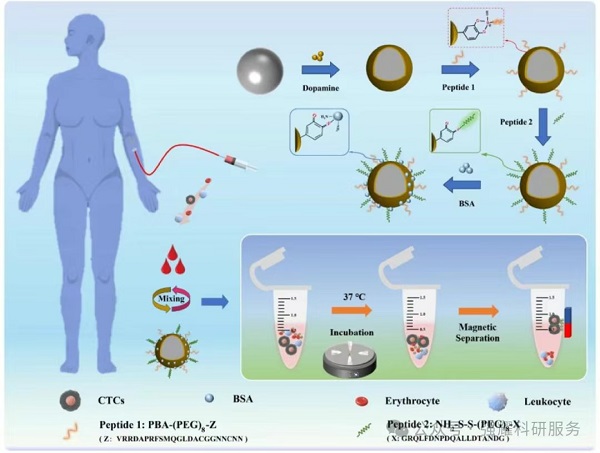
Fig 1. MPMB的制备及其在ctc捕获中的应用示意图
(2)表征结果:SEM显示磁性纳米颗粒平均粒径约200.05±52.49nm,PDA修饰3小时后粒径增至239.75±35.82nm,形貌均一;XRD证实晶体结构与标准Fe₃O₄一致;TGA、zeta电位及XPS验证PDA涂层、肽和BSA成功嫁接,提升颗粒稳定性(表征结果见Fig2)。
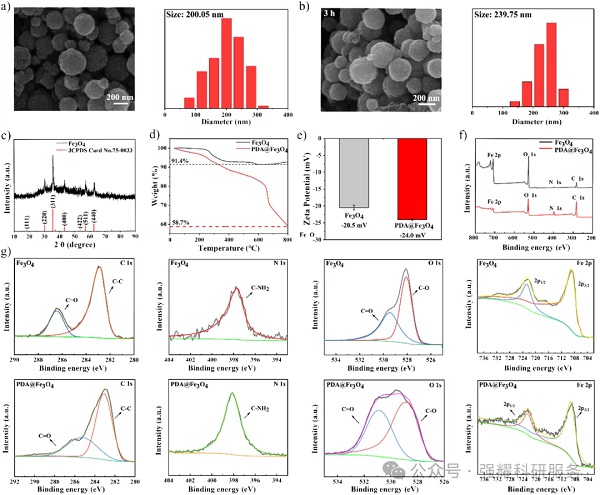
Fig 2. MPMB平台材料表征结果
2. 细胞靶向肽性能与细胞实验结果
(1)肽的合成与生物相容性:靶向EpCAM和HER2的肽经HPLC纯化后纯度分别为96.31%和97.31%,ESI-MS确认分子量与预期一致;CCK-8实验显示肽及MPMB无显著细胞毒性,生物相容性优异(结果见图Fig3 a-b)。
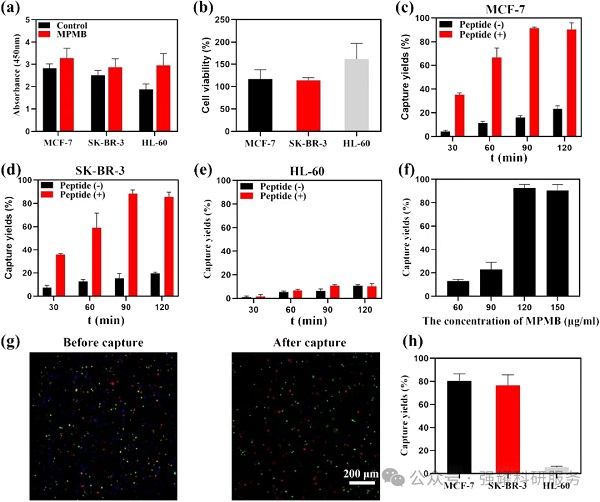
Fig 3. 细胞靶向肽性能与细胞实验结果
(2)捕获效率与特异性:90分钟孵育时,MPMB对MCF-7(EpCAM高表达)和SK-BR-3(HER2高表达)捕获效率达91.44±0.92%和88.25±3.32%;120μg/mL为最佳浓度,MCF-7捕获效率达92.50±3.19%;混合细胞中对HL-60(无EpCAM/HER2)捕获率仅5.55±0.77%,特异性显著(结果见Fig3 c-h)。
3. 临床样本检测结果
(1)不同人群检测率:40例乳腺癌患者CTC阳性率70%,30例良性肿瘤患者6.7%,30例健康对照0,差异显著。
(2)诊断效能与病理关联:区分乳腺癌与非乳腺癌个体的ROC-AUC为0.8421,区分乳腺癌与良性肿瘤的AUC为0.8342;CTC计数随肿瘤分期升高而增加,与淋巴结转移、远处转移显著相关,远处转移患者阳性率达90.9%。
(3)术后变化:10例乳腺癌患者术前CTC均阳性,术后2周阳性率降至40%,计数显著减少。
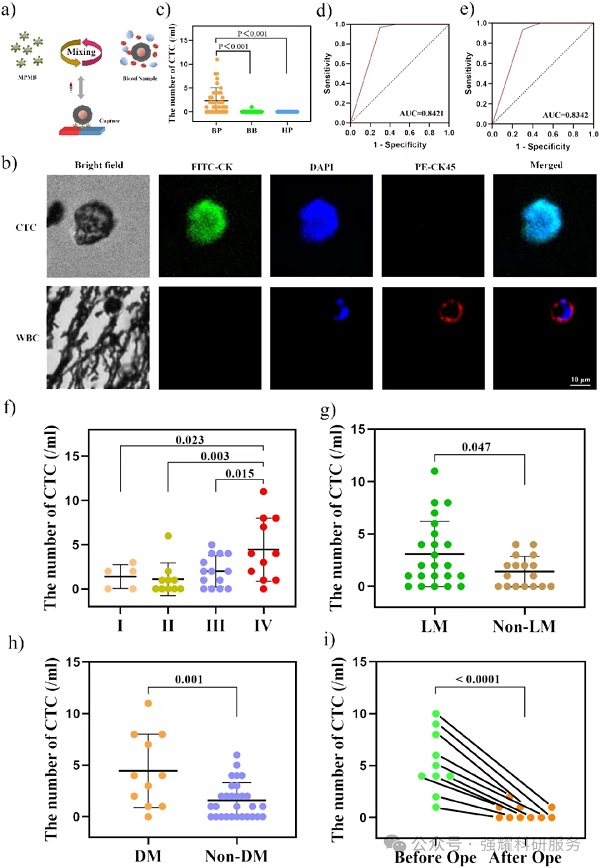
Fig 4. 临床样本检测结果
4. 与现有技术的比较优势
相较于CellSearch®,MPMB仅需1mL外周血(CellSearch®需7.5mL),总处理时间120分钟(快33%);采用双特异性肽靶向EpCAM和HER2,将MCF-7捕获效率从66.6%提升至92.5%,乳腺癌患者阳性率从50%提升至70%,减少因异质性导致的假阴性。
四、结论及意义
综上所述,本研究成功构建的MPMB平台,通过PDA涂层修饰磁性纳米颗粒,嫁接双靶向肽(EpCAM 和 HER2)及BSA抗污层,实现了对乳腺癌CTCs的高效、特异捕获。该平台生物相容性好、操作简便,在临床样本中表现出高灵敏度和特异性,可有效区分乳腺癌与良性病变及健康人群,且CTCs计数与肿瘤分期、转移状态相关,能监测术后疗效。
其意义在于为乳腺癌患者提供了一种新的检测工具,有助于早期诊断、疗效监测和预后评估,具有广阔的临床应用前景。
本研究中 PBA-(PEG)₈-Z和 NH₂-S-S-(PEG)₈-X 由强耀生物提供,强耀生物提供多肽合成,蛋白和抗体制备等优秀服务助力科研


 联系我们
联系我们
 返回
返回