全基因组分析表明,只有15%的蛋白质是可成药的,这意味着大多数蛋白质属于不可成药蛋白,它们缺少与小分子结合的位点或口袋。如果通过开发新方法来靶向这些不可成药蛋白是当前新药研发的一个重点,例如PROTAC技术就是近年来蓬勃发展的新兴蛋白质降解策略,其利用人体自身的泛素-蛋白酶体系统诱导靶蛋白的泛素化,进而选择性消除致病蛋白。
α-突触核蛋白(α-synuclein)是帕金森病(PD)等神经退行性疾病发病机制的核心,α-突触核蛋白会发生错误折叠、寡聚化和形成纤维,这些纤维在神经元之间传播、聚集,并与神经退行相关。促进α-突触核蛋白纤维化的一个主要因素是其浓度,因此,降低α-突触核蛋白的水平是一种潜在的疾病治疗策略。然而,由于α-突触核蛋白是一种内在无序蛋白(IDP),缺乏通常可以被小分子结合靶向的口袋,因此被认为是不可成药蛋白。
而如果能直接靶向mRNA,在蛋白质形成将mRNA降解掉,就能抑制蛋白质的产生,从而绕过不可成药蛋白的靶向难题。
2024年1月5日,美国斯克里普斯研究所 Matthew Disney 教授团队(童玉铨、Peiyuan Zhang为论文第一作者)在《美国国家科学院院刊》(PNAS)发表了题为:Decreasing the intrinsically disordered protein α-synuclein levels by targeting its structured mRNA with a ribonuclease-targeting chimera 的研究论文。
该研究筛选到了一种靶向编码α-突触核蛋白(α-synuclein)的SNCA mRNA并抑制其蛋白翻译的小分子——Synucleozid-2.0,将该小分子转化为一种核糖核酸酶靶向嵌合体(RIBOTAC)——Syn-RIBOTAC,能够选择性降解SNCA mRNA,显著降低了其表达的α-突触核蛋白水平,并恢复了约50%受α-突触核蛋白异常积累而表达失调的基因。
这项研究表明,对于不可成药蛋白,可以通过小分子靶向其mRNA来实现对不可成药蛋白的间接靶向,这为开发神经退行性疾病潜在疗法打开了新大门。

通讯作者Matthew Disney教授(左),第一作者童玉铨(右)
α-突触核蛋白是治疗帕金森病(PD)的重要药物靶点,但它本质上是一种内在无序蛋白,缺乏典型的小分子结合口袋。相比之下,编码α-突触核蛋白的SNCA基因的mRNA的5′非翻译区(5′ UTR)是具有有序结构的区域。
在这项研究中,研究团队提出了一种综合方法来识别能够结合SNCA mRNA的5′ UTR区并抑制α-突触核蛋白翻译的小分子。它们研究了一种药物样、RNA聚焦的化合物库,从中识别了一种药物样小分子——Synucleozid-2.0,其能够结合到SNCA mRNA的5′ UTR,通过抑制核糖体组装到SNCA mRNA上来降低α-突触核蛋白水平。
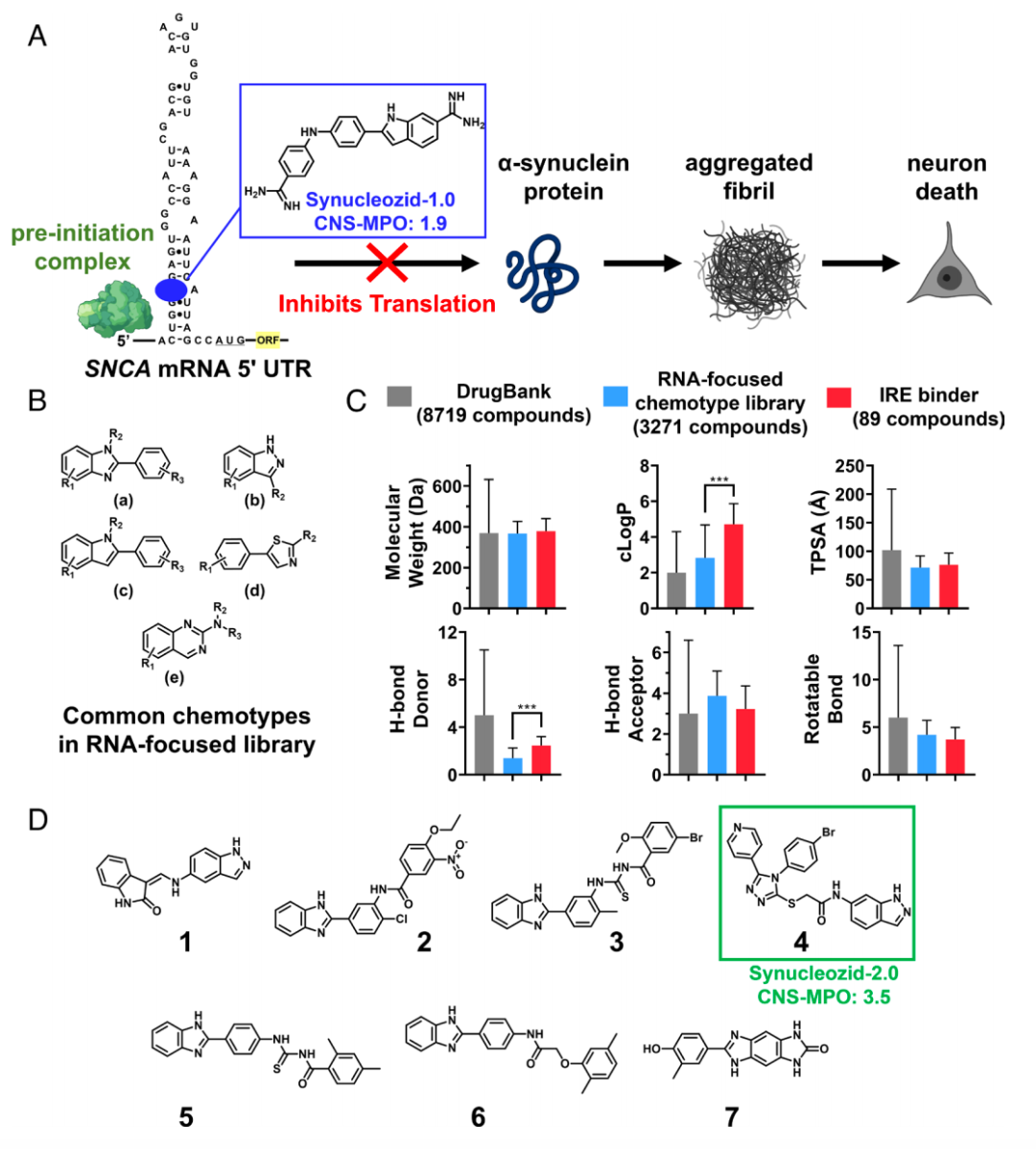
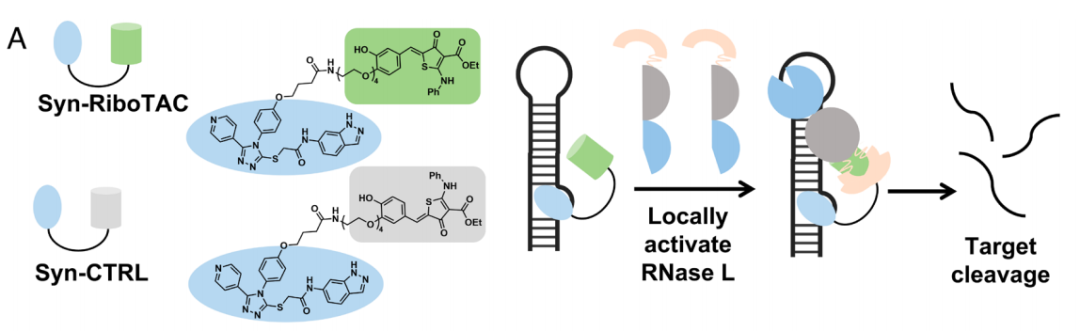
然后,研究团队将这种RNA结合小分子转化为一种核糖核酸酶靶向嵌合体(RIBOTAC)——Syn-RIBOTAC,以降解细胞内的SNCA mRNA。RNA测序和蛋白质组学研究表明,Syn-RIBOTAC选择性地降解了SNCA mRNA,并显著降低了其表达的α-突触核蛋白水平。
帕金森病患者中观察到显著的转录组水平变化,α-突触核蛋白的降低可能允许一些因其异常积累而失调基因的恢复,α-突触核蛋白降低降低的下游效应也可以缓解细胞应激,使细胞恢复正常的功能和基因表达模式。
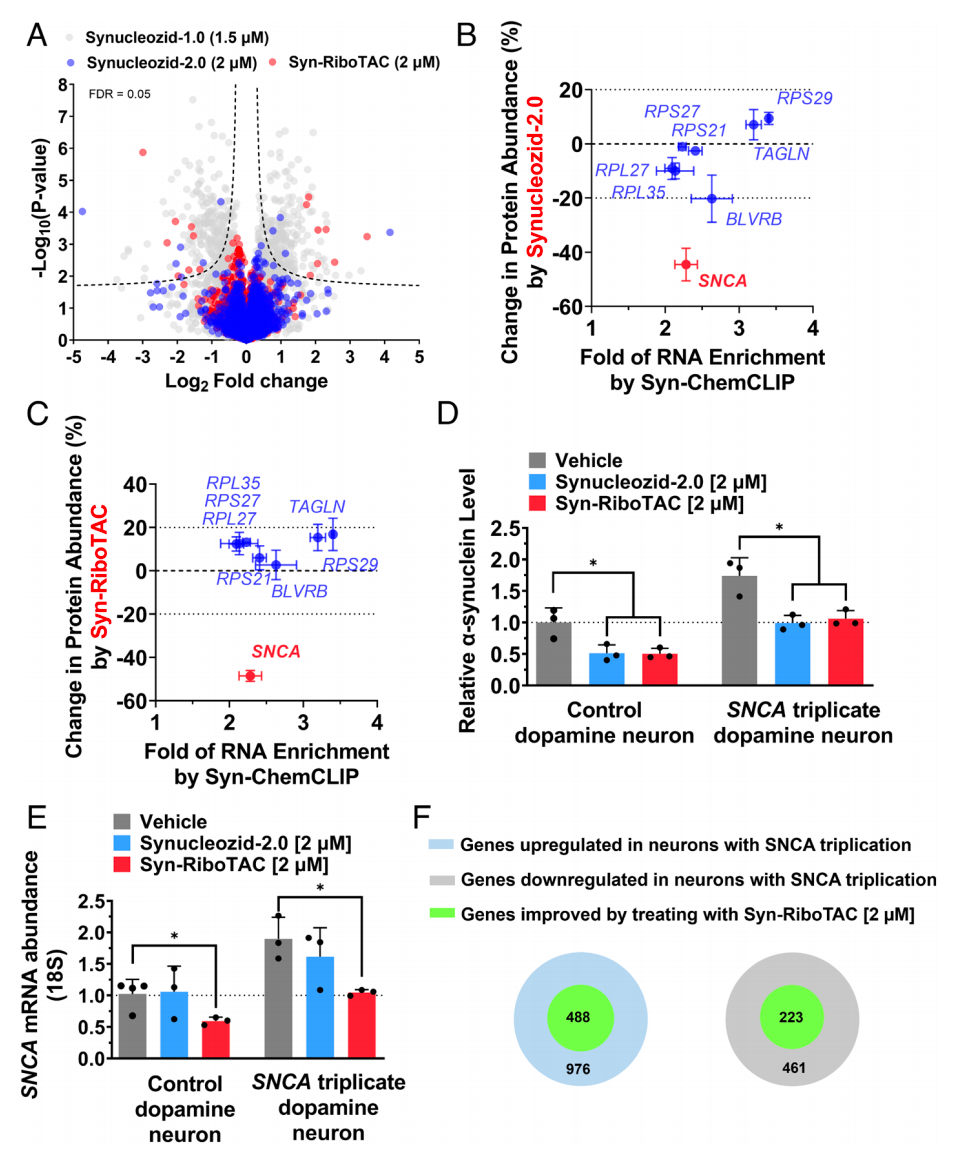
这些研究表明,通过使用小分子结合剂和RIBOTAC技术来靶向编码mRNA,可以极大地扩展蛋白质组的药物可及性。这项研究是一个新突破,表明传统观念上“不可成药”的蛋白质如α-突触核蛋白可以通过mRNA结合被靶向,通过小分子结合剂和降解剂扩大了疾病相关蛋白质的可制药性。
论文通讯作者 Matthew Disney 教授创立了基于RIBOTAC技术的公司Expansion Therapeutics,致力于开发治疗靶向RNA的小分子药物,以治疗肌强直性营养不良、渐冻症、额颞叶痴呆以及tau蛋白病等疾病。



 联系我们
联系我们
 返回
返回