p53是最著名的肿瘤抑制因子,由TP53基因编码,通过调控细胞周期阻滞和细胞死亡来响应各种应激信号,维持细胞稳态。超过50%的人类癌症中存在TP53突变,在某些类型的癌症中比例更高,例如基底乳腺癌(88%),高级别浆液性卵巢癌(96%)。在这些突变中,最常见的是错义突变,通常涉及单个氨基酸的变化,例如S241F、R248W、R273H、R282W和R175H。
与野生型(WT)p53蛋白相比,错义突变p53(mutp53)蛋白在细胞中稳定积累到高水平。这些突变p53蛋白失去了WT p53的抗癌活性,还获得了致癌功能,导致增强的肿瘤发生、侵袭、转移和治疗耐药性。
由于mutp53在人类癌症中的广泛存在和在肿瘤进展中的关键作用,靶向mutp53蛋白是一种有吸引力的癌症治疗策略。然而,缺乏特异性自噬受体限制了这种治疗策略。
华南理工大学张云娇教授、杨显珠教授及南方医科大学温龙平教授等人在 Nature 子刊 Nature Nanotechnology 上发表了题为:Nanoreceptors promote mutant p53 protein degradation by mimicking selective autophagy receptors 的研究论文。
该研究开发了仿生纳米受体(NR),这些纳米受体可以模拟选择性自噬受体,能够结合突变型p53蛋白,提高自噬小体形成水平,增加突变型p53的降解。这些纳米受体在体外和患者来源的异种移植卵巢癌模型中得到了验证。这项研究为通过蛋白质降解来治疗疾病奠定了基础。

在各种针对mutp53的治疗方法中,诱导mutp53降解是最直接的。由于蛋白酶体的狭窄腔隙,它们无法有效降解大型蛋白质聚集物,自噬(Autophagy)作为主要的替代蛋白质降解途径被调用。由于自噬受体(Autophagy Receptor)的存在,自噬可具有高度选择性。
自噬受体具有通过泛素结合域和ATG8/LC3/GABARAP(LC3)蛋白质通过LC3结合区域结合货物的能力,然后将货物传递到初始自噬小体中进行吞噬,并最终通过溶酶体降解。值得注意的是,特定的自噬受体,例如SQSTM1/p62、OPTN、NBR1和NDP52,已被报道介导亨廷顿蛋白、磷酸化tau蛋白和肠道沙门氏菌的降解。然而,选择性自噬如何降解特定蛋白质仍不清楚。
在原理上,一个能够与mutp53和自噬机制相互作用的适当自噬受体可以促进mutp53聚集物进入自噬小体,从而增强mutp53的降解。而提高自噬水平的能力将是一个额外的理想功能。
在这项研究中,研究团队提出了多功能仿生纳米受体(nanoreceptor)的设计,可以同时结合mutp53,增加自噬,并介导mutp53的降解。该纳米受体是由马来酰亚胺-聚乙二醇-聚乳酸(Mal-PEG-PLA)纳米颗粒(NP)自组装形成的,其中包含了1,2-二油酰基-3-三甲基铵丙烷(DOTAP,一种阳离子脂质),然后与mutp53结合肽(MBP)共价修饰。
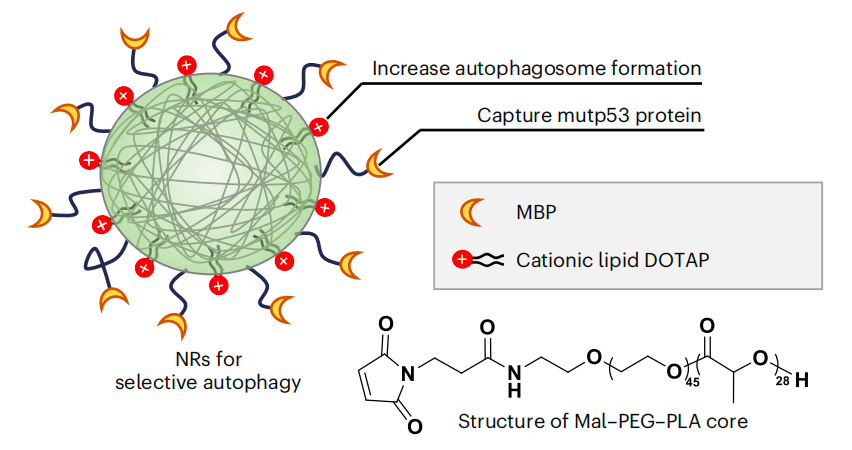
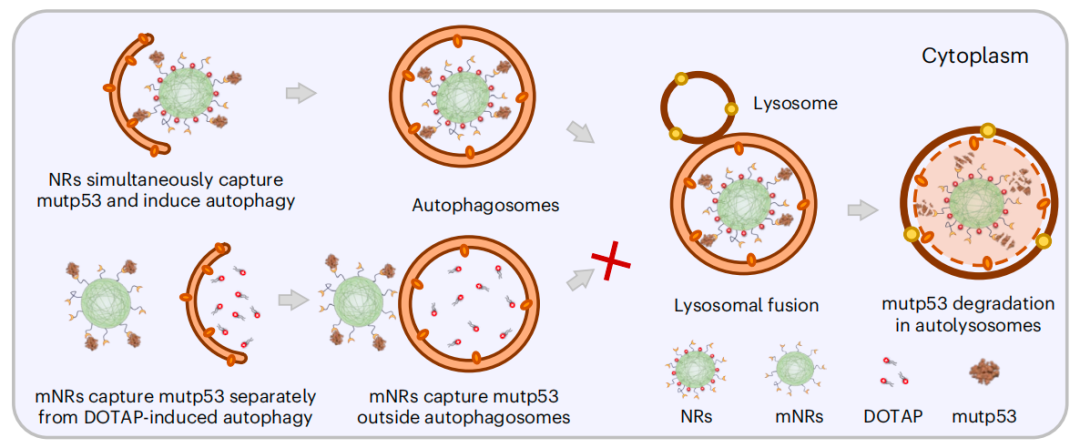
一方面,纳米受体(NR)表面的mutp53结合肽(MBP)靶向并结合到mutp53。另一方面,阳离子脂质DOTAP通过诱导自噬体形成增加来提高自噬水平,并协助将纳米受体结合的mutp53带入自噬小体。这些纳米受体在体外和患者来源的异种移植(PDX)卵巢癌模型中得到证实。
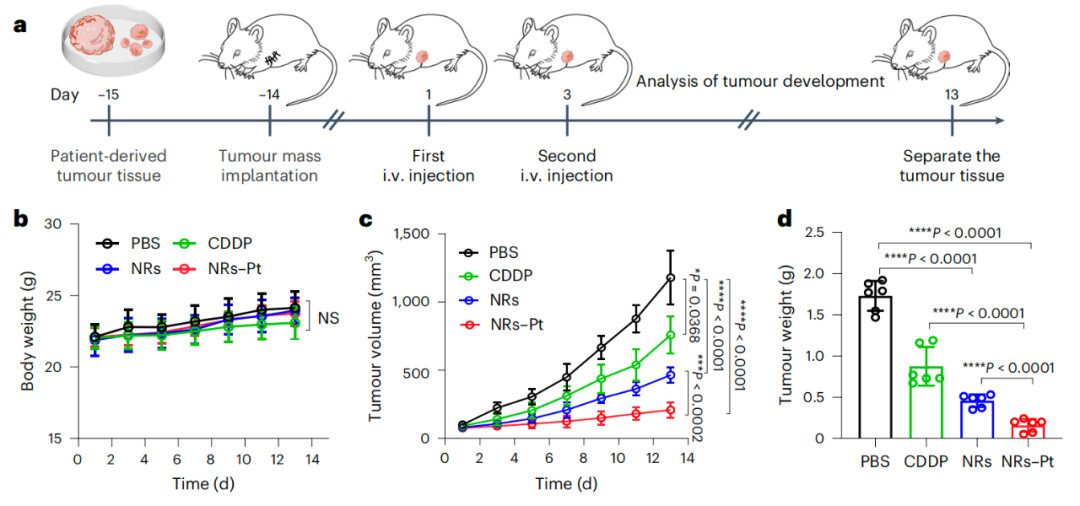
纳米受体在PDX卵巢模型中表现出显著的治疗效果
总的来说,纳米受体(NR)作为mutp53特异性自噬受体发挥作用,实现了mutp53的高效自噬降解,这项研究强调了通过蛋白降解治疗疾病的可能方向。


 联系我们
联系我们
 返回
返回