胃癌(GC)是最常见的癌症之一,也是全球癌症相关死亡的第三大原因。GC预后较差,容易复发和转移。癌症转移的第一步是局部浸润到邻近的基质和周围的正常细胞,通过上皮-间质转化(EMT)获得间质表型,增加自身迁移、侵袭和抗凋亡能力。EMT的第一阶段是上皮细胞之间接触的破坏,如紧密连接(TJ)、粘附连接、桥粒和间隙连接。
CLDN是TJ蛋白家族,参与调节上皮层的通透性、屏障功能和极性。Claudin18.2(CLDN18.2)是CLDN中研究最多的。因为与其他组织或癌症相比,它在胃和GC组织中特异性表达,这使其成为潜在的治疗靶点。
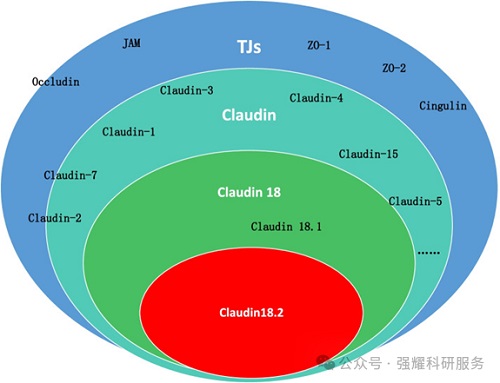
TJ和Claudins的分类,doi:10.1186/s40364-022-00385-1
1 什么是Claudin18.2蛋白?
CLDN是一个至少包含27个跨膜蛋白的家族,根据序列的差异分为经典类型和非经典类型。CLDN18属于非经典类型,由细胞质的N端区域、两个细胞外环(ECL-1和ECL-2)、四个跨膜结构域和细胞质的C端尾部组成。
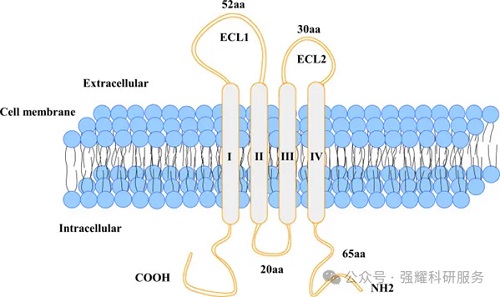
CLDN18蛋白的结构示意图,doi: 10.3389/fonc.2023.1132319
CLDN18基因有两个剪接变体,编码两种亚型:CLDN18.1,和CLDN18.2,来自第一个外显子的选择性剪接。
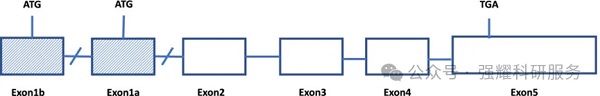
人类CLDN18基因座,doi:10.1186/s40364-022-00385-1
2 CLDN18.2蛋白表达
CLDN18.2是一种高选择性标记蛋白,仅在分化的胃粘膜上皮细胞中表达,在正常健康组织中表达高度有限,并且在未分化的胃干细胞中不表达。在正常健康组织中,CLDN18.2通常存在于胃粘膜细胞的紧密连接中,维持胃粘膜的屏障功能,并防止胃酸中的H+通过细胞旁途径渗漏。
当胃上皮出现癌变时,CLDN18.2被异常激活,高选择性、稳定地表达在肿瘤组织中。在细胞的恶性转化过程中,细胞极性变化导致细胞表面CLDN18.2表位暴露,能够被抗体靶向结合,成为了一个理想的抗肿瘤靶点。CLDN18.2过表达也在其他几种类型的癌症中被发现,包括胰腺癌(PC)、食道癌、卵巢腺癌和肺癌,这也表明CLDN18.2在其他肿瘤的诊断和治疗中的潜力。
3 胃癌中CLDN18.2的异常
(1)CLDN18.2表达:大约20-30%的GC患者中,CLDN18.2表达下调或缺失,其下调被认为与癌细胞侵袭和增殖水平的增加有关。此外,一种被认为是CLDN18表达的抑制因子的衰减抑制了GC细胞的增殖。然而,支持CLDN18下调与GC发生之间相关性的证据仍然有限。
(2)涉及CLDN18的融合:根据癌TCGA数据,3%的GC患者和10%的弥漫性GC患者中,都检测到CLDN18-ARHGAP融合基因。CLDN18.2 C端PDZ结合基序的缺失,破坏了紧密连接复合物,导致通过其他CLDN如ZO1与细胞内肌动蛋白丝的相互作用的丧失。由于Rho GAP结构域的存在,这种破坏导致转化蛋白RHOA的下游失活,潜在地导致恶性转化。总之,还没有确凿的证据表明CLDN18.2表达与癌变之间存在直接联系。
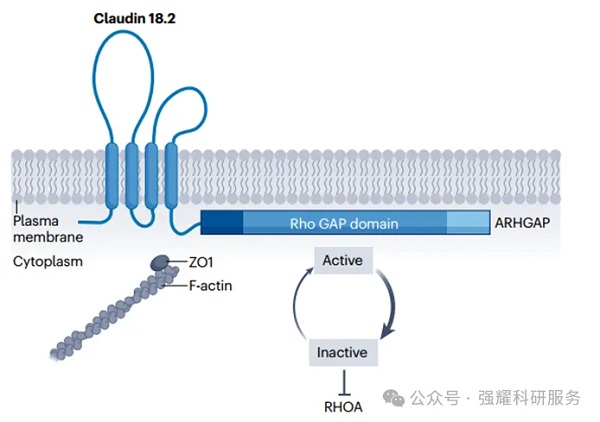
CLDN18–ARHGAP融合图,doi: 10.1038/s41571-024-00874-2
4 其他肿瘤中CLDN18.2的作用
已知CLDN18.2在多种其他癌症类型中过度表达。CLDN18.2的异位表达可能通过PKC或ERK信号通路诱导。在GC、PC和胆管癌细胞以及其他CLDN中,下游靶点--激活蛋白AP-1,已被证明可以增强CLDN18.2 mRNA翻译。在小鼠胆管腺癌异种移植模型中,CLDN18的敲除也被证明可以抑制细胞增殖和肿瘤生长。然而,这是唯一证明CLDN18.2直接激活增殖信号。大多数证据表明,CLDN 18.2的异位表达发生在恶性转化过程中。
CLDN18.2在非胃癌中的表达可能反映了一种独特的癌症亚型。如CLDN18.2阳性非小细胞肺癌往往主要是早期肿瘤,其特征是增殖缓慢和缺乏甲状腺转录因子1表达;而在结肠癌中,CLDN18.2表达和CDX2(成熟结肠上皮组织的一种既定生物标志物)之间呈反比关系。
在胰腺导管腺癌(PDAC)和相关癌前病变中广泛观察到CLDN18.2的异位表达。胰腺上皮的胃型分化,可能是高水平CLDN18.2表达的恶性转化为PDAC的基础。卵巢癌前或交界性恶性病变中也有CLDN18.2异位表达的报道。针对GC的CLDN18.2靶向治疗的可用性也可能为其他实体瘤的CLDN18.2过表达亚群提供新的靶向治疗。值得注意的是,一项评估zolbetuximab联合化疗作为CLDN18.2阳性转移性PDAC患者一线治疗的疗效的II期试验目前正在招募患者(NCT03816163)。
5 CLDN18.2靶向治疗
在世界范围内,靶向CLDN18.2靶点的药品类型涉及单克隆抗体、双特异性抗体、CAR-T以及ADC,几乎包含了当下主要的生物创新药形式,而大部分在研项目是单抗药物。
5.1 单克隆抗体
Zolbetuximab:第一个靶向CLDN18.2的单抗。它属于人鼠嵌合IgG1单抗,包含一个活性Fc结构域,可通过ADCC和CDC诱导肿瘤细胞凋亡。3月26日,Zolbetuximab(Vyloy)在日本获批上市,获批适应症为晚期胃癌。它成为全球首个也是唯一一个获得监管机构批准的CLDN18.2靶向治疗药物,其获批是基于SPOTLIGHT和GLOW两项3期临床研究的结果。
zolbetuximab的II期和III期临床试验,doi: 10.1038/s41571-024-00874-2
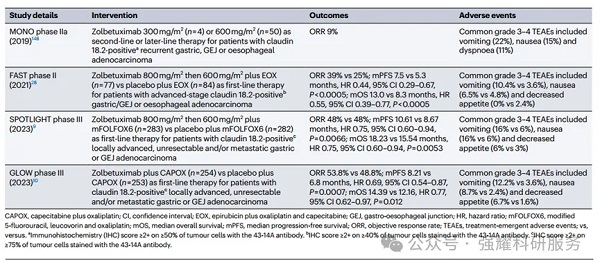
其它进入临床研究的单克隆抗体还包括Osemitamab(TST001)、AB011、MIL93、ASKB589和ZL-1211等。
5.2 双特异性抗体/三特异性抗体
不同的研究表明,用ADC或双特异性抗体(bsAB)靶向CLDN18.2可能是治疗GC和PC的有效治疗方法。临床研究重点已从新型单抗转向双特异性单抗和三特异性单抗,通过与T细胞上的CD3结合并靶向CLDN18.2来引导T细胞,以低毒性提高T细胞的细胞毒性。
(1)双特异性T细胞接合剂(BiTE)
结合CLDN18.2和CD3的bsAB:Gresonitamab、QLS31905、ASP2138和AZD5863。
Gresonitamab:在一项涉及AGC或PDAC患者的国际多中心I期研究中进行了测试(NCT04260191)。据知,这项研究已经完成,但结果尚未公开披露。
QLS31905:在一项I期试验中进行了测试,该试验涉及重度预处理晚期实体瘤患者。
测试ASP2138(NCT 05365581)和AZD5863(NCT 06005493)的I期研究正在进行中。
(2)bsAB与其他靶标结合
Q-1802:同时靶向CLDN18.2和PD-L1。它对肿瘤细胞产生抗体依赖性细胞毒性作用,同时阻断PD-1途径,激活适应性免疫。表达CLDN18.2的实体瘤的1期试验正在进行中。
PT886:同时靶向CLDN18.2和CD47。该药物正在一项开放标签的I期试验中进行测试,涉及晚期胃和GEJ腺癌(PDAC)患者。
Givastomig(TJ-CD4B/ABL111):同时靶向CLDN18.2和4-1BB。目前正在美国和中国的中心进行一期试验(NCT04900818)。
5.3 CAR-T
CAR-T细胞是一项革命性的发展,将这项技术应用于治疗包括胃肠道癌症在内的实体肿瘤患者方面正在取得进展。
CT041:靶向CLDN18.2的二代CAR-T细胞产品,包含一个CD8α铰链区,一个CD28共刺激结构域和一个CD3ζ信号传导结构域。该研究目前正在进行中,CT041在一项验证性Ib/II期研究(NCT04404595)中进行了进一步的研究。
其他几种靶向CLDN18.2的CAR-T细胞疗法目前正在早期研究中进行测试,包括含有4-1BB共刺激结构域的二代CAR-LB1908和四代CAR-T细胞,都被设计用于分泌特定的细胞因子和趋化因子RD07和CT048。CLDN18.2靶向CAR-T细胞可能成为晚期CLDN18.2阳性胃肠道癌症患者的重要治疗方法。
5.4 ADC
ADC正在蓬勃发展,尽管迄今为止公开披露的临床数据仅针对两种CLDN18.2靶向ADC: SYSA1801和CMG901。其他大多数仍处于早期临床试验阶段,包括TPX-4589/LM-302、RC118、SKB315、SOT102、TORL-2-307-ADC和JS107。
SYSA1801:全人单克隆抗体,以单甲基Auristatin E(MMAE)作为有效负载,药物抗体比(DAR)约为2。在针对含有CLDN18.2阳性细胞的实体瘤(包括具有CLDN18.2阳性细胞的肿瘤细胞)的临床前研究中显示出活性。正在进行一期试验(NCT 05009966)。
CMG901:以MMAE作为有效负载,DAR约为4。一项1期剂量递增试验已证明在先前治疗过的表达CLDN18.2的实体瘤中具有安全性和临床活性。
5.5 与CLDN18.2抗体融合的肽
LB4330:一种与CLDN18.2抗体融合的新型肽,靶向肿瘤抗原相关的CD8+T细胞。它具有单独或与PD-1/PD-L1 mAb联合治疗晚期实体瘤的潜力,特别是针对CLDN18.2阳性PDAC。目前正在进行LB4330在晚期实体瘤患者中的I期试验(NCT05707676)。
5.6 基于mRNA的治疗
BNT141:一种创新的基于RNA的治疗药物,编码抗CLDN18.2抗体,包裹在脂质纳米颗粒中,是该治疗类别中首批进入临床测试的产品之一。一项测试BNT141的I/II期、开放标签、多中心试验(NCT04683939)于2020年12月启动,招募目标为48名患者,但主办方于2023年10月终止了该研究,原因尚未披露。基于mRNA的疗法应用于临床实践之前,还需要进行大量的进一步研究和开发。
由于其在特定肿瘤组织中的高选择性和稳定表达,CLDN18.2近年来成为抗肿瘤药物的热门分子靶点。随着Zolbetuximab与化疗联合治疗方案的兴起,与其他靶向药物的联合治疗也可能值得追求。未来CLDN18.2靶向治疗研究还应关注肿瘤细胞的微环境和代谢特征。对CLDN18.2异位表达的进一步研究也可能使CLDN18.2靶向治疗扩展到PDAC或其他实体瘤患者的亚群。
强耀生物多年来致力于为科研机构提供多肽、蛋白和抗体等一站式服务。为助力您的肿瘤研究,我们可以提供Claudin18.2靶点蛋白和抗体等相关产品。如果您有相关需求,请随时联系我们。


 联系我们
联系我们
 返回
返回