靶向治疗的概念起源于德国科学家Paul Ehrlich 提出的专门杀死导致体内疾病的病原体,而不伤害身体本身的理念,后随着时间发展迁移到癌症治疗。2000年,辉瑞推出首个抗体靶向偶联药物(ADC)mylotarg,此后十年间又有14款ADC药物问世。尽管ADC药物取得长足进展,但也存在局限性,促使研究人员开发新的靶向偶联药物,多肽偶联药物(PDC)因此应运而生。
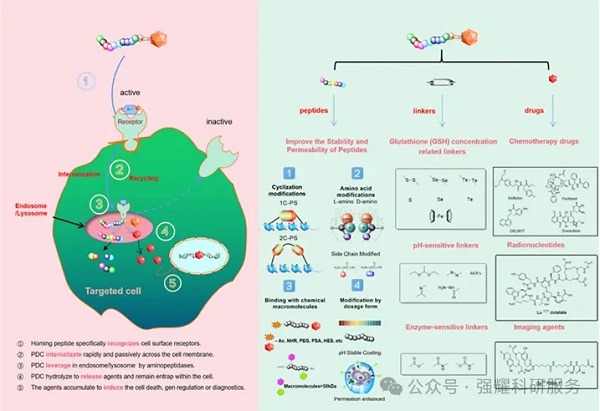
PDC药物相关机制
1、ADC与PDC比较
ADC在21世纪之后得到了比较长久的发展,对于ADC抗体的设计,linker的选择,payload 小分子药物的修饰是研究的热点。
ADC药物开发的理想靶点应该有如下的特点:1)靶点在肿瘤组织高表达,在正常组织低表达或有限组织中表达;2)抗原位于细胞表面,易于与抗体特异性结合3)靶点应该属于内化抗原范畴,结合ADC药物后可促使药物内吞进入细胞后发挥作用。目前ADC的作用靶向局限在仅占人类蛋白质~10%的胞外靶标,ADC的靶点HER2、EGFR、Trop2和Mesothelin等是ADC研发中重复最多的靶点,赛道拥挤。
ADC药物目前的面临局限性有:1)具有复杂结构的ADC药物的生产成本仍然居高不下;2)给药方式只能注射不能口服,也让很多肿瘤患者望而却步;3)ADC的纯化工艺、产品质量控制较为复杂.
设计更灵活、给药方式多样、价格更亲民的新型靶向药物亟待开发。
基于ADC的优点和缺点,研究人员开发出PDC药物。PDC的设计一般由归巢肽(Homing peptide),连接子(Linker),具有细胞毒性的有效载荷(payload)。可以通过化药的形式进行申报。兼具分子量小、肿瘤穿透性强,免疫原性低、利用固相合成法可大规模获取、生产成本较低,药代动力学良好的PDC药物,有望成为继小分子靶向药,单克隆抗体、ADC药物之后的新一代靶向抗肿瘤药。
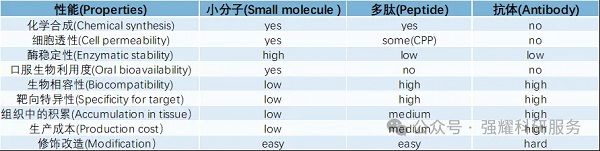
不同药物类别之间的差异
2、二.PDC药物设计
2.1 靶点
PDC药物除了靶向细胞表面的一些靶标外,对多肽进行修饰后具有更好的细胞膜穿透能力,与细胞内的靶点进行结合,不局限于结合位点一定是在细胞膜外。
因此PDC靶向所需组织一般有两种情况,一种情况是,PDC遵循与ADC类似的过程,首先内化,然后在细胞内裂解,释放细胞毒素。另一种情况是在细胞外发生裂解,然后细胞毒素内化。其具体作用机制取决于多种因素,包括连接子和归巢肽。
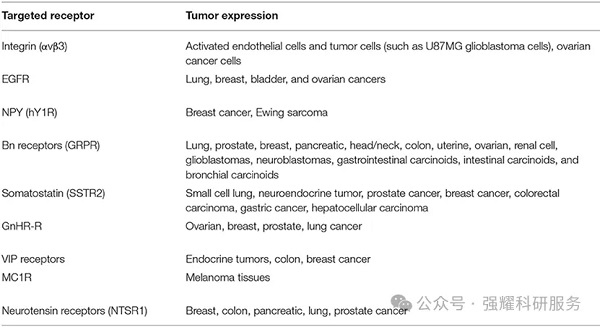
抗癌药物递送研究的肽结合受体
2.2归巢肽
归巢肽能够特异性靶向肿瘤组织中过度表达的蛋白受体,引导PDC进入目标细胞并限制其向其他部位输送。
归巢肽的二级结构对其与受体结合的能力有显著影响,常见的二级结构包括α螺旋、β折叠和无规则缠绕。为了提高归巢肽的亲和力,需要保持其稳定的二级结构,即使在通过连接子与细胞毒素偶联时也不应破坏这一结构。
PDC中使用的肽分为两类:细胞穿透肽(CPPs)和细胞靶向肽(CTPs)。CPPs通过非特异性机制进入细胞,而CTPs通过特异性结合肿瘤细胞表面的抗原或受体,介导细胞毒性有效载荷进入肿瘤细胞。由于CPPs的低细胞特异性,其应用受到限制;而CTPs表现出与单克隆抗体类似的作用,同时克服了单克隆抗体的某些缺点,因此被广泛应用。
目前,双环毒素肽 (BTP)、树突状肽和自组装增强肽已被证明可作为药物递送系统。
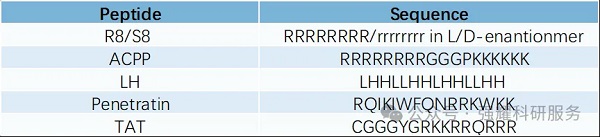
穿膜肽
2.3连接子
连接子在PDC中的稳定性至关重要,以避免药物在血液循环中过早或非特异性释放,这可能导致严重的安全问题甚至致命副作用。连接子可分为可裂解和不可裂解两种类型:
可裂解连接子:可以通过酶学或化学方式裂解,例如pH值变化、谷胱甘肽(GSH)还原或肿瘤微环境中的酶。
不可裂解连接子:不会因化学或酶的作用而断裂,其机制是多肽/蛋白首先被代谢掉,留下有效载荷-连接子片段,该片段能够从内涵体/溶酶体中逃逸并杀死细胞。
此外,还需考虑连接子在体内的代谢过程及其代谢产物的毒性。
通过多肽递送细胞毒素的靶向疗法,提高了治疗效果并减少了对健康细胞的伤害。细胞毒素作为PDC的有效载荷,具备血液循环中的稳定性、高效力和可连接性。此外,PDC不仅用于治疗,还可用于成像。通过多肽与放射性核素偶联,归巢肽能选择性地结合目标组织上的受体,几乎不脱靶,放射性核素可通过各种扫描技术对肿瘤进行成像精确定位肿瘤。
2.5 稳定性
与肽类药物类似,PDC的主要缺点之一是循环稳定性差,肾脏清除速度快,为提高PDC药物在体内的稳定性,人们通过化学修饰和物理技术(环化、化学修饰、制剂优化) 及通过纳米材料增强PDC的PK特性。
PDC药物主要有多肽-毒性小分子,多肽-干扰性小分子、多肽-核素这几大类,在合成生产的过程中遇到的问题既不同于小分子也不同于多肽,从工艺难度、生产难度、质量控制难度,结果确认难度和稳定性的一些方面来阐述一下PDC药物的一些难点。
3.1工艺难度
PDC药物的小分子活性位点普遍很多,反应的选择性差,而能用到的化学合成手段有限。其次从目前合成结果来看,PDC药物的小分子最后的收率较低,再加上毒性小分子价格昂贵,导致研发、生产和商业化成本高。还有,PDC药物的多肽部分除了固相合成外,还大量使用了液相合成的手段,对设备要求高。并且PDC药物受多肽和小分子双重影响,可能出现药物稳定性、溶解性、杂质控制等问题。进而影响制剂产品和工艺的开发,无论是储存温度、还是辅料的选择比传统的多肽药困难。
3.2生产难度
在生产管理中,PDC分子是由三段连接起来的,细胞毒性分子按GMP要求需专线生产。但有很多小分子尚未上市,所以在IND阶段能包容使用非GMP的产品,但在NDA阶段需要有GMP管理。
在生产完毕后需对PDC药物进行结构确认。需鉴定多肽的序列及高级结构。小分子的若有手性位点,这些手性位点的一些表征可能也是需要检测。小分子是否正确的接到多肽的某一个氨基酸也需验证。多肽和小分子连接起来后结构与单独的多肽和小分子有差异,核磁共振结果受多肽和小分子相互干扰影响分析起来更复杂。
目前有两款已获批的PDC药物,分别为应用于骨髓瘤的Melfulfen和治疗生长抑素受体阳性胃肠胰神经内分泌肿瘤的177Lu-DOTA-[Tyr3]-octreotate。证明了PDC药物在未来癌症治疗中的适用性。目前已有多种PDC药物进入临床,这展示了PDC药物未来巨大的市场前景。


 联系我们
联系我们
 返回
返回