2024年10月9日,蛋白质设计先驱 David Baker 教授与AlphaFold开发者 Demis Hassabis、John Jumpe 共同获得了2024年诺贝尔化学奖。
不管是化疗还是细胞疗法,在癌症治疗过程中都可能带来副作用。这在很大程度上是因为这些疗法不仅会靶向肿瘤细胞,也可能会影响体内的健康细胞。同样,由于肿瘤细胞和健康细胞之间的相似性,设计新的抗癌药物或疗法也具有挑战性。例如,CAR-T细胞疗法,通过工程化改造T细胞,使其识别并靶向肿瘤细胞表面的抗原,从而精准杀伤肿瘤细胞,但实际上,这些抗原往往在非肿瘤细胞上也有所表达,从而导致所谓的非肿瘤靶向毒性(On-Target Off-Tumor)。
2024年11月14日,David Baker 团队与加州大学旧金山分校 Kole T. Roybal 团队合作,在 Nature 期刊发表了题为:Engineered receptors for soluble cellular communication and disease sensing 的研究论文【1】。
该研究开发了一种高度可定制的工程化受体——合成膜内蛋白水解受体(synthetic intramembrane proteolysis receptor,简称SNIPR),这种受体可以感知周围环境中的分子,并据此改变细胞内基因的表达。基于该受体构建的CAR-T细胞能够只在特定环境中被激活(例如在肿瘤附近),从而减少非肿瘤靶向毒性(On-Target Off-Tumor)。
肿瘤小鼠模型实验显示,SNIPR-CAR-T细胞特异性靶向并显著缩小了肿瘤,对健康组织的影响最小,且没有产生CAR-T细胞疗法中常见的副作用。

研究团队表示,这项研究可能会导致癌症疗法的发展,通过向肿瘤的精准递送,让细胞疗法更有效,且副作用更少,还可能为癌症之外的其他疾病(例如自身免疫疾病)带来新型靶向疗法。
尽管近年来哺乳动物合成生物学取得了显著进展,但仍缺乏能够对可溶性配体产生稳定响应并进而激活特定细胞功能的模块化合成受体。
这种受体在调节工程化细胞疗法活性方面具有广泛的临床潜力,然而,到目前为止,已上市的和进入临床试验的细胞疗法都只靶向位于肿瘤细胞表面的靶点。
早在2016年,Kole T. Roybal 曾作为第一作者在 Cell 期刊发表论文【2】,开发了一种新型传感器——synNotch受体,将该受体整合到T细胞表面,能够识别肿瘤细胞并激活免疫反应。但这种工程化受体只能识别肿瘤细胞表面的配体,依赖于细胞之间紧密的物理接触来发挥作用。
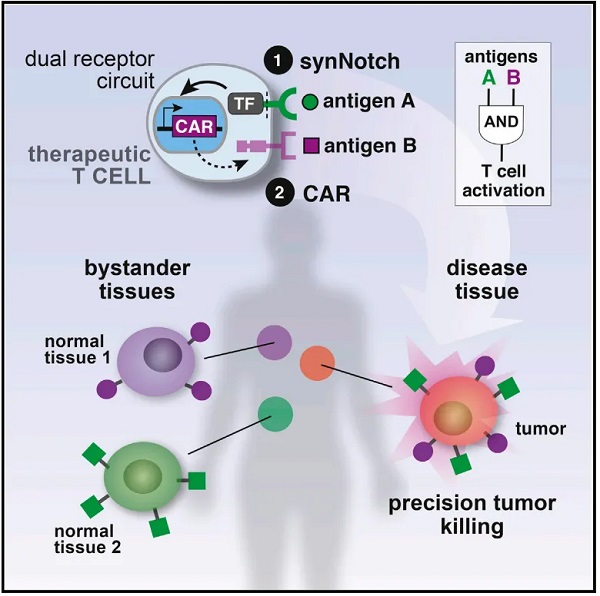
肿瘤细胞由健康细胞演化而来,这导致它们之间其实非常相似,肿瘤细胞表面的蛋白质往往也存在于健康细胞表面。这就是导致只能被细胞表面蛋白激活的受体在实际应用中非常受限。实际上,肿瘤所产生的许多其他分子可能在识别肿瘤环境方面更有用。
在开发出synNotch受体后,Kole T. Roybal 一直在研究对synNotch受体的升级改造。最终促使他们开发出了新的工程化受体——合成膜内蛋白水解受体(SNIPR),SNIPR不只能够被细胞表面配体所激活,还能被可溶性配体所激活,因此可以感知并结合细胞周围环境中的可溶性分子或自由漂浮分子,例如肿瘤环境中的免疫信号分子。当这些分子与相应的SNIPR结合时,多个受体会聚集并翻转到细胞内部,直接与细胞内的DNA相互作用,从而改变基因表达。此外,在一个细胞上表达多个SNIPR,可以调控不同的基因,或以不同的方式调控同一个基因。从而实现对基因活性的打开、关闭或调控。
近年来,嵌合抗原受体T细胞(CAR-T)疗法在血液类肿瘤中产生了令人印象深刻的强大疗效,该疗法通常通过基因工程改造来自癌症患者的T细胞,再回输到患者体内,使其识别和攻击癌细胞。然而,CAR-T细胞疗法在占据癌症类型和数量绝大多数的实体瘤中却不太成功,其中部分原因是实体瘤细胞缺乏可被T细胞识别的肿瘤特异性抗原。
在这项最新研究中,研究团队将新设计的SNIPR整合到了CAR-T细胞中(通过电穿孔整合到基因组特定位点,降低使用病毒载体可能带来的风险),他们设计靶向两种可溶性免疫分子TGF-β和VEGF的SNIPR,这两种分子通常在肿瘤环境周围高水平存在。
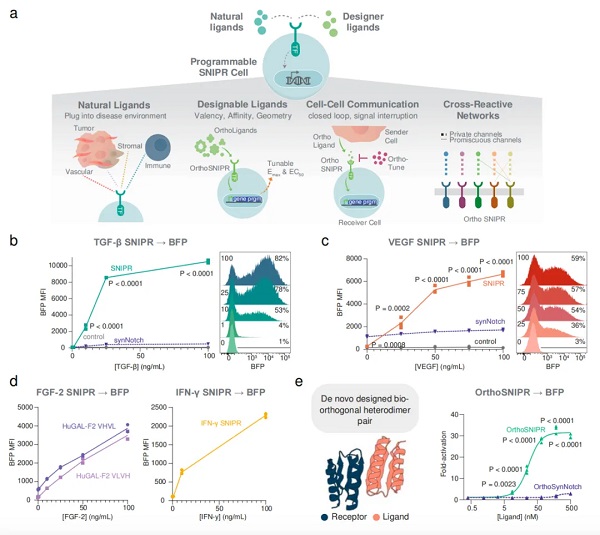
体外实验表明,只有在TGF-β和VEGF存在的情况下,SNIPR才会启动CAR-T细胞的抗肿瘤活性,因此,这些CAR-T不会在不受癌症影响的身体区域启动免疫应答,从而减少非肿瘤靶向毒性(On-Target Off-Tumor)。
接下来,研究团队进行了体内验证,在携带人类肿瘤的小鼠体内,SNIPR-CAR-T细胞能够特异性地靶向并攻击肿瘤,在没有引起CAR-T细胞疗法常见的副作用(例如体重减轻、器官损伤)的情况下显著缩小了肿瘤,最大限度地减少对健康组织的损伤。
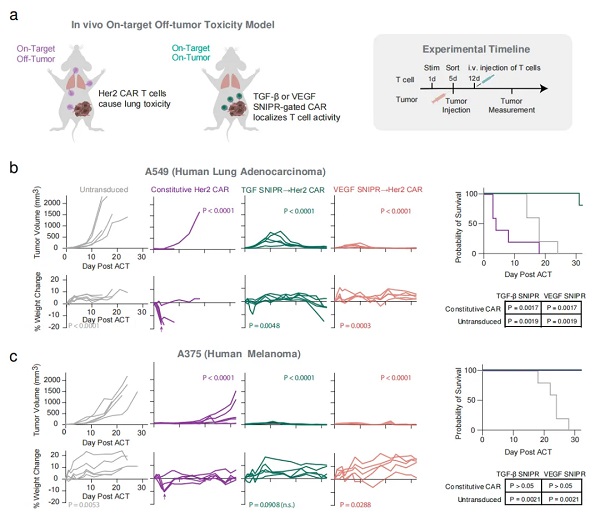
论文共同通讯作者、2024年诺贝尔化学奖得主 David Baker 教授表示,这让免疫疗法有了双重验证,首先,免疫细胞必需处于特定环境中(例如肿瘤周围)才可能启动免疫反应,然后,免疫细胞本身再去识别并攻击癌细胞。
SNIPR作为一个扩展平台,能够与一系列天然配体或合成配体相互作用(不管其是拴系的还是可溶性的),从而实现对细胞的精确调控,用于基础研究和疾病治疗。SNIPR的多功能特性使其成为改进当前细胞疗法的有力工具,有望实现更安全的细胞治疗,同时也可能用于自身免疫性疾病的治疗。
据悉,该团队正在继续研究在多种细胞类型中使用SNIPR的方法,使用它们来介导不同细胞类型之间的通信。此外,Arsenal Bio公司正在CAR-T细胞临床试验中验证该技术,Kole T. Roybal 是该公司的联合创始人。
相关阅读:
2024年10月17日,西湖大学生命科学学院谢琦、曹龙兴团队(夏真、金启涵为共同第一作者)在 Nature 子刊 Nature Biomedical Engineering 上发表了题为:Targeting overexpressed antigens in glioblastoma via CAR T cells with computationally designed high-affinity protein binders 的研究论文【3】。
该研究利用计算蛋白质设计,从头设计了靶向胶质母细胞瘤细胞表面高表达的肿瘤抗原EGFR和CD276的高亲和力结合蛋白(binder),代替典型的scFv来构建CAR-T细胞,用于胶质母细胞瘤的治疗,显示出了更强的实体瘤治疗效果。

该研究开发了一种策略,利用从头设计的结合蛋白(de novo-designed binder,DNDB)代替典型的scFv作为肿瘤表面抗原结合域,以增强CAR-T细胞的抗肿瘤潜力。该研究从头设计的EGFR和CD276 binder CAR -T细胞不仅局限于靶向胶质母细胞瘤,还可能有效治疗许多其他高表达EGFR或CD276的实体瘤,例如非小细胞肺癌和胰腺导管腺癌。
据悉,研究团队已与临床医院合作,正在开展CD276 binder CAR-T细胞治疗复发性胶质母细胞瘤的研究者发起的临床实验(IIT)。


 联系我们
联系我们
 返回
返回