近日,河南大学赵美霞教授课题组开发了一种新型双壳核靶向智能纳米平台(HMCuS/Pt/ICG@MnO2@9R-P201,简称HMCPIM9P)并探究了其在肝细胞癌细胞中的应用。该平台能通过近红外光(NIR)照射,协同增强化疗、光动力疗法(PDT)、光热疗法(PTT)、化学动力疗法(CDT)和免疫疗法。
该研究发表在《Journal of Colloid And Interface Science》上,题为“Nuclear-targeted smart nanoplatforms featuring double-shell hollow mesoporous copper sulfide coated with manganese dioxide synergistically potentiate chemotherapy and immunotherapy in hepatocellular carcinoma cells”
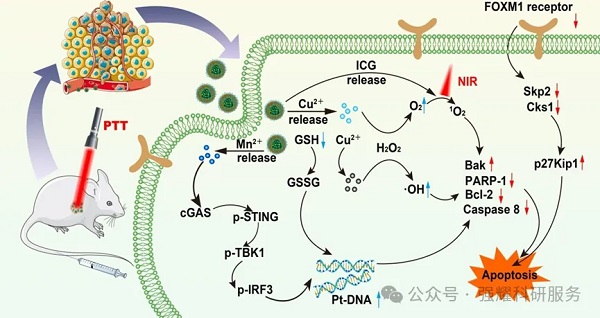
1、研究背景
肝细胞癌(HCC)是全球第六大常见的恶性肿瘤,其发病率逐年上升。传统的化疗药物如顺铂(Pt)在低浓度下疗效不佳且对正常组织有毒性。此外,肿瘤微环境中的低pH、缺氧和高谷胱甘肽(GSH)水平也限制了治疗效果。因此,开发一种高效、低毒的治疗策略显得尤为重要。
铂(Pt)作为一种有效的铂基抗肿瘤药物,通过与DNA结合形成Pt/DNA复合物,抑制细胞增殖。
空心介孔硫化铜(HMCuS)和二氧化锰(MnO2):HMCuS具有优异的光热转换性能和生物相容性,MnO2能有效消耗GSH并提供氧气,增强化疗效果,并且利用Mn2+可诱导的免疫原性细胞死亡(ICD),增强循环中的GMP-AMP合成酶(cGAS)和刺激干扰素基因(STING)的激活。
9R-P201靶向肽:能使合成的纳米颗粒显示出更优的稳定性和更精准的核靶向能力。其中9R是9聚D-精氨酸,具有强大的细胞膜穿透能力;P201肽能进入细胞核并抑制肝癌细胞的FOXM1c的作用。
2、研究方法
1. 纳米平台构建
研究人员设计了一种新型的核靶向双壳智能纳米平台。该平台的核心由双壳多功能纳米颗粒(HMCuS@MnO2)组成,能够有效递送光敏剂吲哚菁绿(ICG)和化疗药物顺铂(Pt)。此外,该平台还通过消耗谷胱甘肽(GSH)来增强治疗效果。具体来说,HMCuS@MnO2纳米颗粒能够有效地消耗肿瘤细胞内的谷胱甘肽(GSH),从而提高ICG和Pt的疗效。
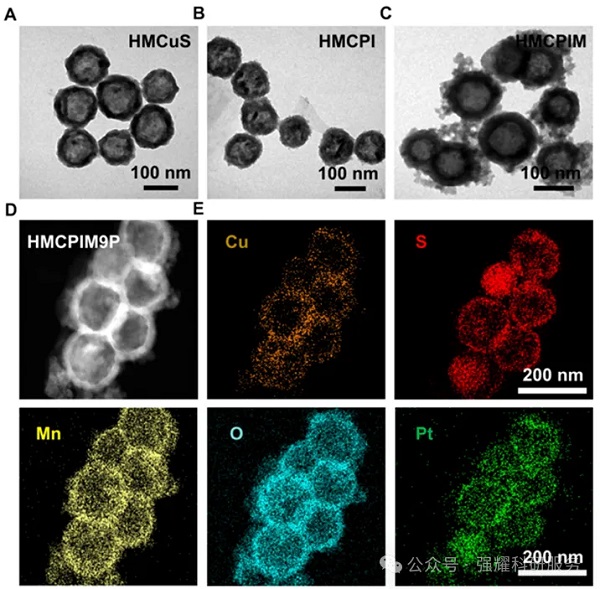
HMCPIM9P纳米粒子的形态和结构特征
双壳智能纳米平台具体的构建方法为: NPs。
首先,合成空心介孔硫化铜纳米颗粒(HMCuS NPs)作为核心结构。通过物理搅拌法将光敏剂吲哚菁绿(ICG)和化疗药物顺铂(Pt)负载到HMCuS NPs中。
接着,通过二氧化锰(MnO2)涂层进一步修饰纳米颗粒,形HMCuS/Pt/ICG@MnO2 NPs。
最后,通过酰胺反应将9R-P201多肽偶联到纳米颗粒表面,形成最终的HMCuS/Pt/ICG@MnO2@9R-P201 NPs。
2. 性能评估:
首先通过透射电子显微镜(TEM)、傅里叶变换红外光谱(FT-IR)、X射线衍射(XRD)等手段对纳米颗粒进行了表征。然后,评估了纳米颗粒的光热性能、药物释放特性、细胞摄取情况以及细胞毒性。接着,在小鼠模型中验证了纳米颗粒的体内分布、抗肿瘤效果和免疫激活能力。
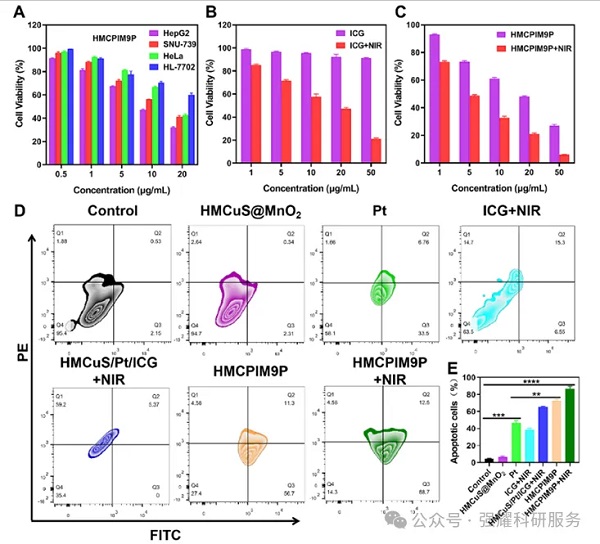
HMCPIM9P纳米粒子细胞毒性和抗肿瘤活性
3. 研究结果
实验结果显示,HMCPIM9P纳米平台在近红外光(NIR)照射下,能够显著抑制肿瘤生长,抑制率高达95.6%。同时,该平台还能引发强烈的免疫反应,显著抑制肿瘤的生长和复发。
4. 总结
该研究设计并开发了一种新型双壳核靶向智能纳米平台,通过核靶向递送显著提高了药物在肿瘤部位的浓度,并通过多种疗法的协同作用,显著增强了抗肿瘤效果。这一创新平台在未来的肝细胞癌治疗中具有巨大的潜力。


 联系我们
联系我们
 返回
返回