近年来,癌症免疫疗法取得了显著进展,但头颈部鳞状细胞癌(HNSCC)患者在使用免疫检查点阻断(ICB)疗法时效果有限。这主要是由于肿瘤微环境中存在强烈的免疫抑制特性,限制了免疫细胞的浸润。为了克服这一难题,中山大学光华口腔医学院梁玉洁团队最新研究开发了一种新型多功能纳米药物——C-SMNPs,为HNSCC的免疫治疗提供了全新解决方案。
该项研究发表在《ACS NANO》,题为“Nanosized Shikonin Disrupts Tumor-Cell Mismatch Repair and Synergizes with Manganese to Sensitize Squamous Carcinoma to Immunotherapy”
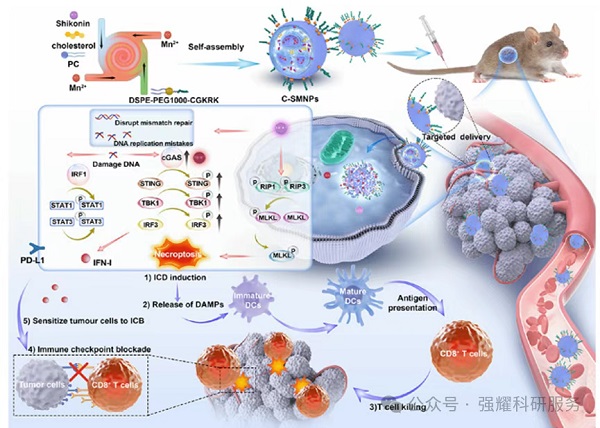
纳米药物C-SMNPs递送的示意图
1、研究背景与挑战
HNSCC是一种常见的恶性肿瘤,其高耐药性和较差预后使其成为临床治疗中的重大挑战。尽管ICB疗法在多种癌症中表现出显著疗效,但在HNSCC中却因肿瘤微环境的复杂性而效果不佳。具体来说,HNSCC的肿瘤微环境具有免疫排斥特性,阻碍了免疫细胞的有效浸润,从而削弱了抗PD-1抗体等免疫疗法的作用。因此,开发能够重塑肿瘤微环境、增强免疫反应的新策略显得尤为重要。
2、实验设计与结果
研究团队首先设计了一种脂质纳米颗粒C-SNPs。这种颗粒通过CGKRK肽修饰,能够特异性靶向高表达HSPG2的鳞状细胞癌细胞,并成功递送活性成分紫草素(SHK)。紫草素作为一种天然化合物,具有诱导免疫原性细胞死亡(ICD)的能力,但由于溶解性和脱靶效应的问题,其临床应用受到限制。C-SNPs的出现解决了这些问题,显著提高了紫草素的稳定性和靶向递送效率。
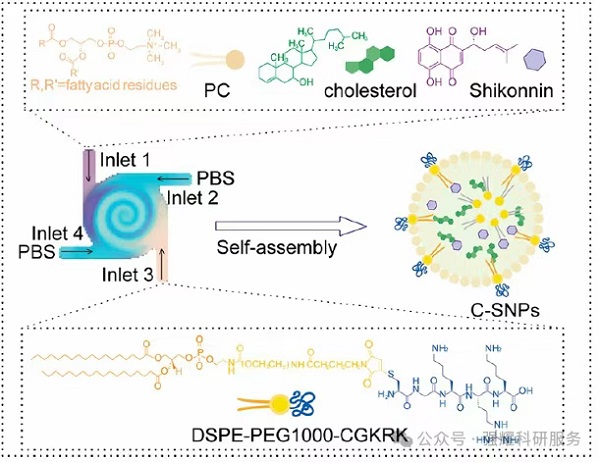
纳米粒子制备示意图
实验结果表明,C-SNPs能够在体内外诱导肿瘤细胞发生坏死性凋亡(necroptosis),同时通过下调错配修复(MMR)相关基因和蛋白表达,触发cGAS-STING信号通路,促进I型干扰素(IFN)的释放。这些变化增强了树突状细胞(DCs)和CD8+ T细胞的浸润,进一步激活了抗肿瘤免疫反应。然而,单独使用C-SNPs与抗PD-1抗体联合治疗时,其对肿瘤生长的抑制效果仍然有限。
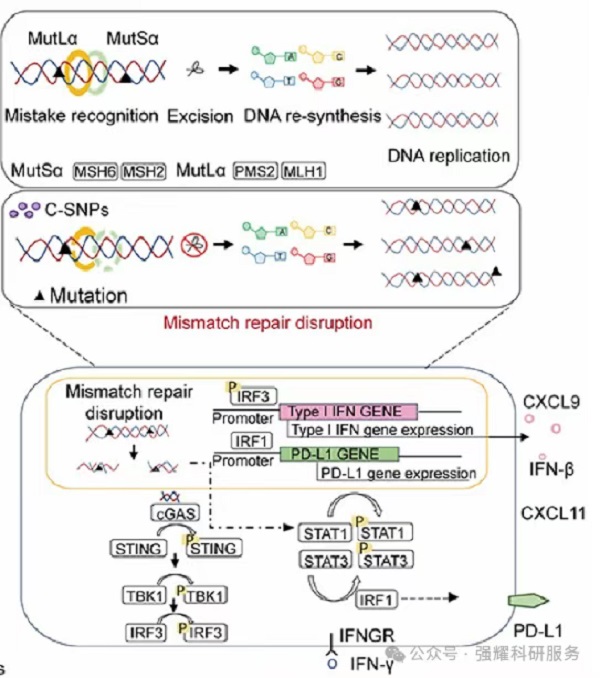
C-SNPs激活cGAS-STING通路并触发IFN反应的机制
为进一步优化治疗效果,研究者将锰离子(Mn2+)引入C-SNPs中,形成了升级版纳米药物C-SMNPs。锰离子能够增强cGAS-STING通路的激活,从而更有效地促进DC成熟和细胞毒性T细胞活化。实验结果显示,C-SMNPs与抗PD-1抗体联合使用时,显著提高了抗肿瘤免疫效果。具体表现为更强的肿瘤生长抑制、更高的生存率以及系统性抗肿瘤免疫反应的建立。
3、总结
本研究开发的C-SMNPs为HNSCC的免疫治疗提供了全新的思路。通过结合紫草素和锰离子的协同作用,C-SMNPs不仅克服了传统免疫疗法的局限性,还显著提升了抗肿瘤免疫效果。未来,研究人员将进一步开展临床前研究,验证C-SMNPs的安全性和有效性,并探索其在其他类型癌症中的潜在应用。
文献DOI:10.1021/acsnano.4c17090
本研究中CGKRK多肽由强耀生物合成。强耀生物提供多肽合成,蛋白和抗体制备等优秀服务助力科研


 联系我们
联系我们
 返回
返回