肽基材料(PBMs)是一类极具吸引力的生物材料,具有良好的生物降解性、高生物相容性和良好的修饰结构。随着化学和生物的不断发展,PBMs在不同的应用场景中被赋予了多种功能,如组织工程、药物输送、生物成像等。多肽还有自组装形成高阶结构的潜力,具有良好的可控制的组装特性和优越的生物功能。由酶、活性氧(ROS)、pH、和光触发的PBMs在活细胞中的可控自组装,可以产生具有广泛功能的肽纳米结构,从疾病诊断到治疗。然而目前常用的化学合成方法需要多步反应,既耗时又不经济,且长肽合成困难。
活细菌已被用于治疗多种癌症。通过对细菌和哺乳动物细胞进行改造来合成PBMs。生物合成具有更好的生物兼容性和生物安全性,减少生产时间和成本;各种功能可以通过在质粒的DNA中添加相应的序列来整合。尽管生物合成优点多,但由于细胞内环境的复杂性,在具有调节功能的活细胞中,精确操纵生物合成PBM的形态变化仍然具有挑战性。
中国科学院化学研究所有机固体院重点实验室的吕凤婷和王树研究员团队制备了一种多肽材料P1,它具有从球状到纤维状的原位转化能力,以诱导肿瘤细胞凋亡。通过在表达P1的大肠杆菌(E.coil)表面包裹阳离子聚芴苯衍生物(PFP),以实现多肽原位释放,构建了一个时空可控的抗癌体系。
重组蛋白P1:由H6-T22-GFP-BAK-KLVFF-RGD构成,具有多种功能,各部分功能如下:
6× His标签:有助于细胞内抗体的纯化和检测;
GFP和T22:作为纳米颗粒和靶向部分的追踪器,可靶向CXCR4+癌细胞;
BAK基序:诱导肿瘤细胞凋亡;
BAK是唯一位于线粒体外膜(MOM)上的促凋亡蛋白。其功能性BH3结构域在线粒体处寡聚,导致细胞色素C和其他促凋亡因子二聚化并释放;
KLVFF:形成带有靶向多肽末端的𝛽片状结构纤维的支架;
RGD肽:增强对整合素𝛼v𝛽3过度表达的肿瘤细胞的靶向作用;
P1抑制肿瘤生长:
组织蛋白酶B(CtsB)是一种在多种肿瘤中过度表达的重要溶酶体蛋白酶,将酶切肽GFLG放置在P3肽段(BAKKLVFF)的两端。由于亲水性GFP多肽和疏水组织序列的整体平衡,P1可以自组装成纳米颗粒,可以靶向肿瘤部位并内化到细胞内。在肿瘤细胞中,P1经CtsB处理后脱落亲水性GFP外壳,分解为P3肽段,纳米颗粒转化为纳米纤维,暴露其活性部位(BH3结构域),使纳米纤维定位于MOM并聚集在一起,介导膜的通透性,导致细胞色素C的释放,从而有效地抑制肿瘤的生长。
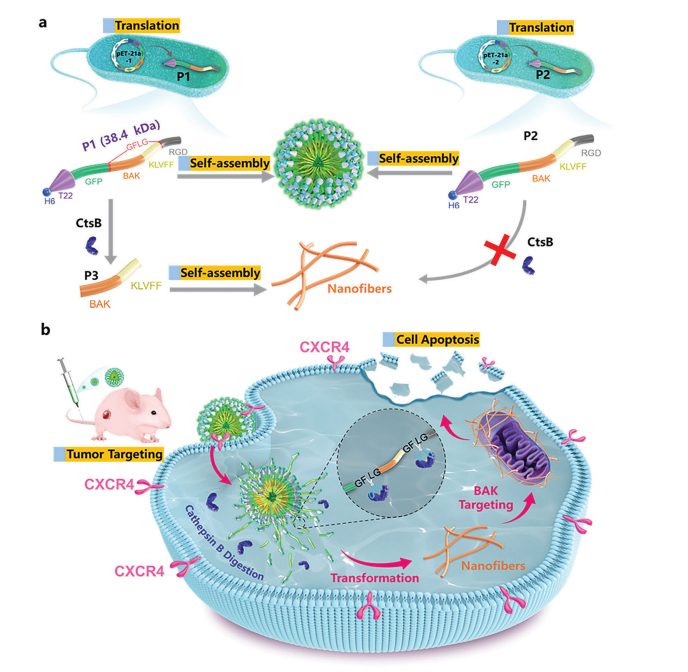
图1. 重组蛋白P1的模块化设计、表达和自组装行为以及形成纳米纤维结构的酶催化形态转化策略的示意图
2 结果和讨论
该研究通过SDS-PAGE、WB和质谱得到P1分子量为38.44 kDa;其自组装呈现出浓度依赖性,随浓度的降低,由球形形态(500 μg/mL)变得稀疏、不规则(50 μg/mL);经CtsB处理10 h后,P1被裂解生成残基多肽P3,观察到明显的纳米纤维结构,且在210和223 nm处显示出负CD信号;根据CD和广角X射线散射(WAXS)结果的分析,得到分子排列模型如图2(g)所示。
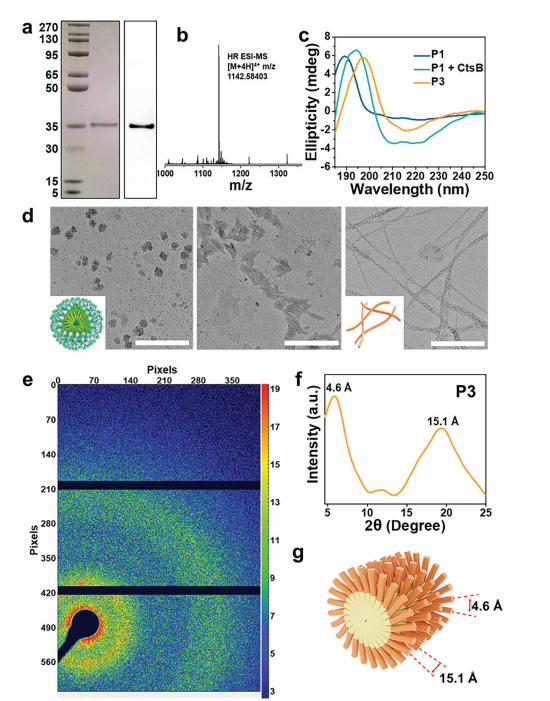
图2. 重组蛋白P1的分子量、自组装形态变化及分子排列模型
与过表达CtsB的HeLa细胞共同孵育48h后,和无酶切位点GFLG的对照多肽P2相比,P1显著诱导了的细胞死亡(IC50值为15.24 μM);同样,P1对过表达CtsB的A375癌细胞也表现出显著的细胞毒性。相同浓度下,P1和P2对低水平表达CtsB的正常HPF细胞株没有毒性。进一步研究了细胞凋亡机制,P1强烈抑制抗凋亡的Bcl2家族蛋白,包括Bcl2、Bclxl和Mcl-1被抑制,而凋亡家族蛋白Bim、Bad、Bax和Bak的表达增加;且经P1处理的癌细胞中细胞色素c、裂解caspase-9和裂解caspase-3的水平增加;这些结果表明,P1通过Bcl2途径诱导线粒体依赖的细胞凋亡。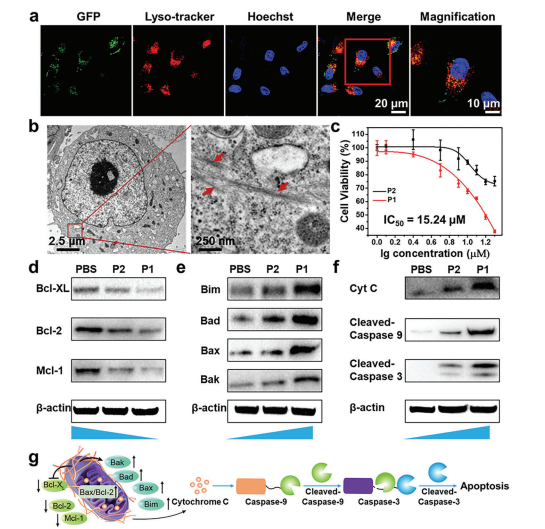
图3. P1处理对HeLa细胞的影响和细胞凋亡图
活细菌疗法由于其优越的肿瘤定植能力,已被提出作为治疗癌症的另一种方法。研究人员用PFP作为光催化剂,包裹表达P1的E.coil,在光照条件下产生ROS,促使E.coil断裂释放表达蛋白P1,该蛋白可以进行形态转化并诱导癌细胞凋亡。
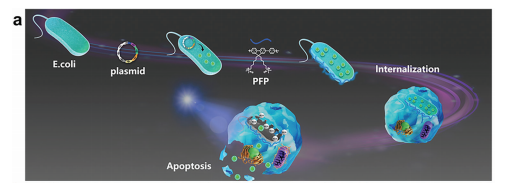
图4. PFP包被的E.coil通过光操纵控制细胞内释放可转化肽的示意图
采用等温滴定、微量热法和zeta电位法确定了PFP通过静电相互作用与E.coil表面结合。细菌膜的损伤有利于包括P1在内的各种细胞内容物的持续释放。40 μM的PFP可以引起高水平的E.coil膜破坏,由图5(c)的扫描电镜可以看出,PFP涂层后外表面保持完整,但变得粗糙。在光照射下,E.coil的塌陷、破裂和融合大大增强,形状几乎无法识别。光照射后,表达的P1的杀伤率显著提高,最高杀伤率达到50%以上;黑暗条件下,48 h和72 h细胞基本不受影响见图5(d),这验证了PFP包被的E.coil具有生物相容性。这些结果表明,通过光操作,以无创和远程控制的方式成功地及时调节活性药物从活菌中释放。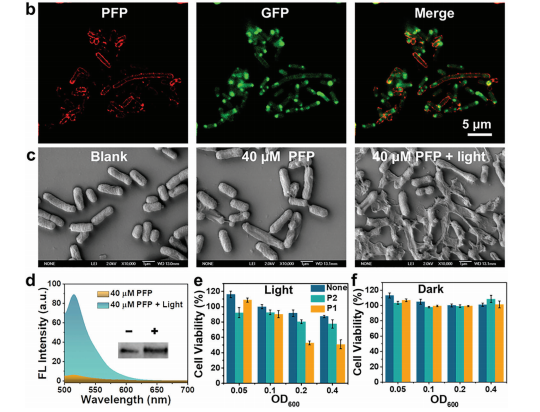
图5. PFP与E.coil的结合、对E.coil形态的影响
和PFP包被E.coil在光照、黑暗条件下对HeLa细胞的杀率
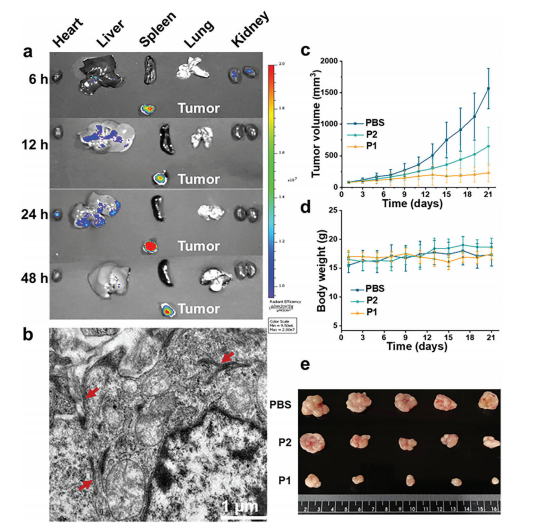
为了在体内评价形态转化对肿瘤聚集和治疗效果的影响,采用宫颈癌的雌性BALB/c裸鼠模型。肿瘤和主要器官的离体荧光成像,证实了生物合成的多肽由于T22的部分而具有良好的肿瘤靶向能力,见图6(a);在切除的肿瘤组织中,P1组静脉给药48 h后,小鼠的肿瘤切片中有纤维结构,P2和PBS组则没有;治疗效果上,P1组的抑瘤效果更为显著,且处理后小鼠肿瘤体积逐渐缩小如图6(c)所示,这可能与消化后暴露活性部位有关;主要脏器染色未见明显病理改变,表明P1治疗肿瘤具有生物相容性;P1处理后的肿瘤组织出现大量坏死,81%caspase-3被裂解,肿瘤组织中Ki-67的表达水平显著降低;这些结果表明,P1促进了癌细胞的凋亡。
图6. (a)单次静脉注射6、12、24和48 h后,P1处理组小鼠肿瘤组织和主要器官的体外荧光强度随时间变化;(b)注射48h后,P1在肿瘤组织中的分布和原位纤维转化的Bio-TEM图像;皮下肿瘤模型小鼠治疗21d期间的相对肿瘤体积(c)和体重变化(d)(n=5);(e)治疗21天后小鼠肿瘤的代表性照片
本研究所涉及到的人工合成的P3肽(BAKKLVFF)由苏州强耀生物科技有限公司提供。


 联系我们
联系我们
 返回
返回