抗体-药物偶联物(ADC)是一种新一代生物治疗药物,由单克隆抗体(mAb)、细胞毒性小分子和连接子三部分组成,如图1所示。ADC将抗体的高特异性与细胞毒性小分子的效力相结合,用以提高肿瘤药物的靶向性、减少毒副作用。ADC药物对靶点的准确识别性,极大地提高了药效,减少了毒副作用并保留了非恶性组织,备受医药研发领域人员的关注。
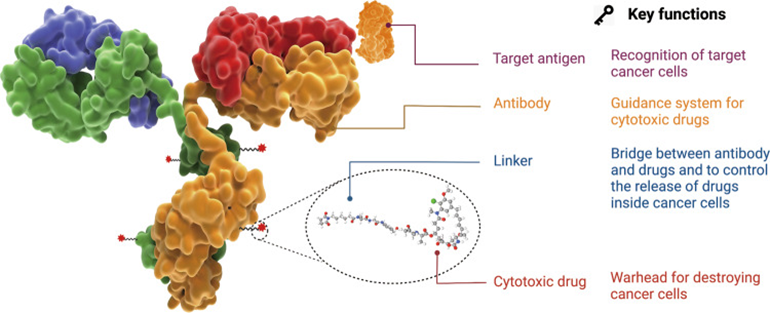
图1. ADC结构和特性,doi: 10.1038/s41392-022-00947-7.
ADC发展历程
20世纪初,德国诺贝尔奖得主Paul Ehrlich首次提出了“魔法子弹”;1975年杂交瘤技术的发展,使得ADC药物飞速发展;2000年,美国FDA首次批准ADC药物吉妥珠单抗ozogamicin(商品名Mylotarg),标志着癌症靶向治疗ADC时代的开始。目前有13个ADC获得批准,还有更多ADC正在开发中。ADC药物从起步阶段到成熟发展阶段的一百年里程碑式事件如图2所示。随着靶点和适应症的不断扩大,ADC正在引领靶向癌症治疗的新时代,并有望在未来成为传统化疗的替代品。
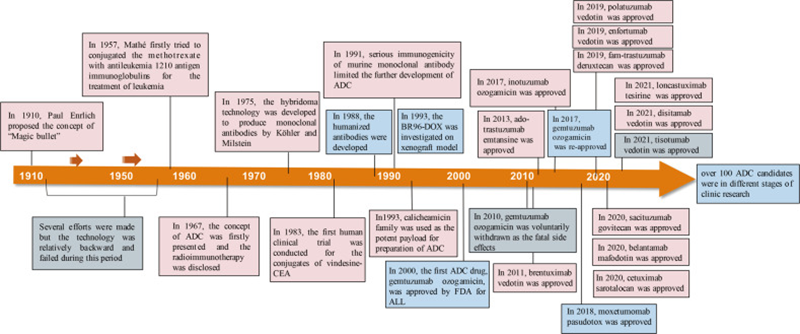
图2. ADC药物开发和批准中的重要事件的时间表,
doi: 10.1038/s41392-022-00947-7.
ADC作用机制
ADC药物进入体内后,单克隆抗体部分与癌细胞上特异性表达的靶抗原结合,ADC被细胞内吞/内化进入肿瘤细胞,最后与溶酶体融合。细胞毒性有效载荷最终通过溶酶体中的化学或酶介导释放,靶向DNA或微管导致细胞凋亡或死亡。当释放的有效载荷具有渗透性或跨膜性时,它还可能诱导旁观者效应,从而增强ADC的功效。此外,这些药物的旁观者效应也可能改变肿瘤微环境,从而进一步增强ADC的杀伤效果。
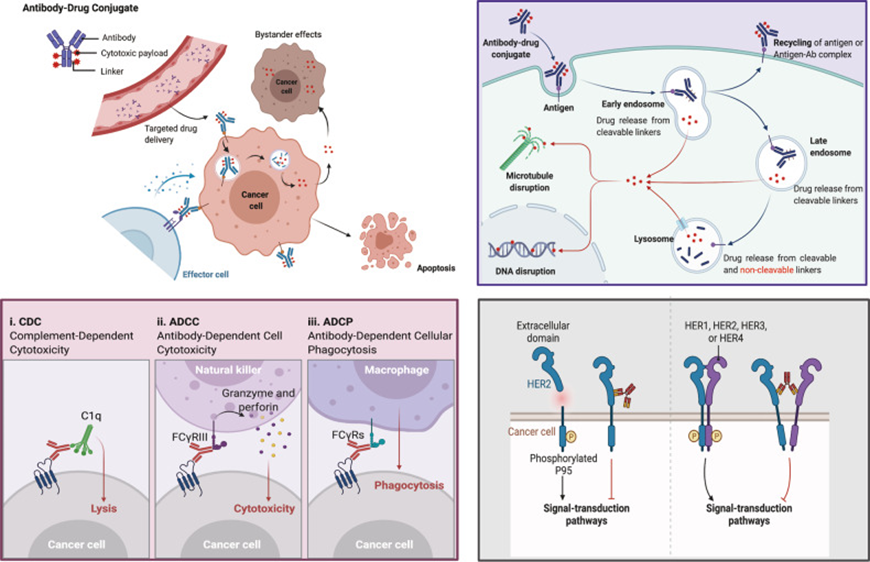
图3. ADC通过不同方法杀死癌细胞的机制,doi: 10.1038/s41392-022-00947-7.
(右上:ADC的主要核心作用机制;左下:ADC的抗体成分与免疫效应细胞结合,引发抗肿瘤免疫,包括补体依赖性细胞毒性(CDC)、抗体依赖性细胞介导的细胞毒性(ADCC)和抗体依赖性吞噬作用(ADCP);右下:ADC的抗体成分保持其活性,因此可以干扰靶功能,抑制下游信号以抑制肿瘤生长。)
ADC的关键组件
3.1 靶抗原筛选
靶点是抗肿瘤活性和ADC耐受性的最重要贡献者,可以存在于肿瘤细胞、肿瘤相关细胞或肿瘤微环境中。选择合适的靶抗原是ADC成功的关键步骤:
1)首先,靶抗原应仅在肿瘤细胞中表达或主要表达,但在正常组织中很少表达或表达较少。理想情况下,抗原是细胞外抗原,而不是细胞内抗原,以便被循环ADC识别。例如,CD30在间变性大细胞淋巴瘤中均高表达,而HER2的扩增和过表达发生在约15-20%的乳腺癌中;
2)靶抗原应该是非分泌的,因为循环中分泌的抗原导致ADC在体循环中结合,增加全身毒性的风险;
3)靶抗原应在ADC结合后有效内化,因为ADC依靠靶受体内化将细胞毒性有效载荷传递到癌细胞。影响抗原-ADC内化的其他因素包括靶抗原上的结合表位以及ADC对抗原的亲和力。
目前,已获批的ADC药物的靶抗原通常是在癌细胞中过表达的特异性蛋白,包括实体瘤中的HER2、trop2、nectin4和EGFR,以及血液系统恶性肿瘤中的CD19、CD22、CD33、CD30、BCMA和CD79b。
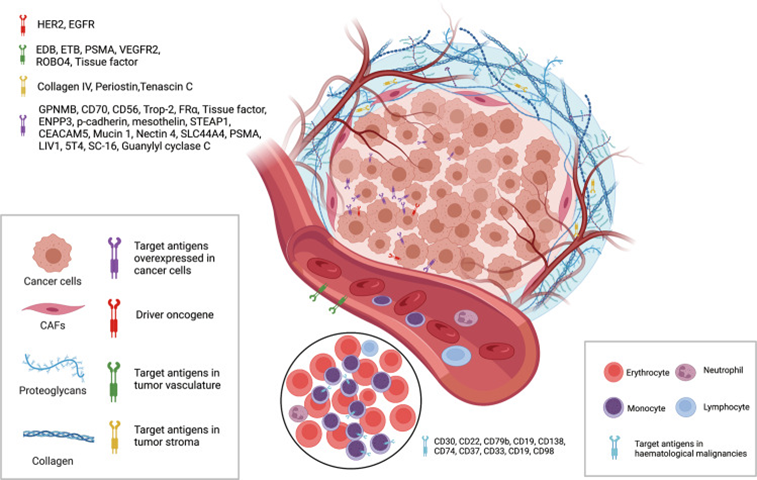
图4. 来自肿瘤细胞和肿瘤微环境的重要靶抗原用于ADC的发展,doi: 10.1038/s41392-022-00947-7.
3.2 抗体部分
肿瘤靶向抗体对于靶抗原与ADC之间的特异性结合至关重要。理想mAb应具有靶标特异性,并具有很强的靶标结合亲和力。此外,它还应具有低免疫原性、低交叉反应性、高效内化和长血浆半衰期。ADC药物开发的早期阶段,主要采用小鼠来源的抗体,免疫原性副作用严重,失败率高。随着重组技术的发展,鼠抗大多被嵌合抗体和人源化抗体所取代。
目前,ADC越来越多地采用完全人源化抗体,显著降低免疫原性;获批的14种ADC药物中,只有brentuximab vedotin使用嵌合抗体。用于ADC药物的抗体多为IgG抗体,IgG1是ADCs常用的亚型,诱导ADCC、ADCP和CDC等强效应功能,在抗体药物的抗癌活性中起着至关重要的作用。
抗体与抗原之间的结合亲和力影响抗体-抗原复合物的内化效率,通常较高的亲和力会导致更快速的内化。然而,高抗原亲和力的抗体反过来可能会减少对实体瘤的渗透。因此,应优化抗原和抗体之间的合理亲和力,以平衡靶细胞的快速吸收和抗癌效力;影响肿瘤穿透的另一个因素是抗体的大小,去除Fc片段使抗体小型化会导致体内半衰期的缩短。因此,在设计具有小型化抗体的ADC时,应考虑各种因素。
3.3 细胞毒性有效载荷
有效载荷(也称为弹头)发挥ADC的细胞内细胞毒性活性。由于只有2%的ADC到达靶肿瘤细胞,因此高效力对于这些化合物的有效性至关重要。目前批准的大多数药物使用的有效载荷主要包括强效微管蛋白抑制剂、DNA损伤剂和免疫调节剂。
微管蛋白抑制剂:包括奥瑞他汀衍生物,如单甲基奥瑞他汀E和F(MMAE和MMAF),美登素衍生物如DM1和DM4。获批的14种ADC药物中,有5种使用MMAE/MMAF作为有效载荷;
DNA损伤剂:包括导致DNA双链断裂的药物(如calicheamicins)、DNA嵌入(如拓扑异构酶抑制剂)、DNA烷基化(如duocarmycins)和DNA交联(如吡咯苯并二氮卓类药物);
免疫调节剂:也称为免疫刺激抗体偶联物(ISAC),包括toll样受体(TLR)激动剂和干扰素基因刺激剂(STING)激动剂。
3.4 连接子
连接子在确保ADC稳定性和优化细胞毒性有效载荷向肿瘤细胞的递送方面发挥着关键作用。有效载荷的接头有两种类型:可切割和不可切割。
可降解接头被设计为在细胞内降解,以响应从细胞外环境到细胞内环境的变化。目前获批的大多数ADC使用可裂解接头,如曲妥珠单抗deruxtecan(T-DXd)。优点是有效载荷的细胞内释放和循环中的稳定性,而缺点包括外周循环中潜在的过早裂解。
不可切割的接头由抗蛋白水解的稳定键组成,依赖于蛋白酶对ADC抗体组分的酶促水解,最终释放出有效载荷“复合物”,即与抗体降解产物中的氨基酸残基相连的药物。如含有4-(N-马来酰亚胺基甲基)环己烷-1-羧酸琥珀酰亚胺酯(SMCC)的曲妥珠单抗emtansine(T-DM1)。潜在优势是限制有效载荷过早释放引起的脱靶毒性;缺点是氨基酸残基仍附着在有效载荷上,影响有效载荷的药代动力学和药效学。
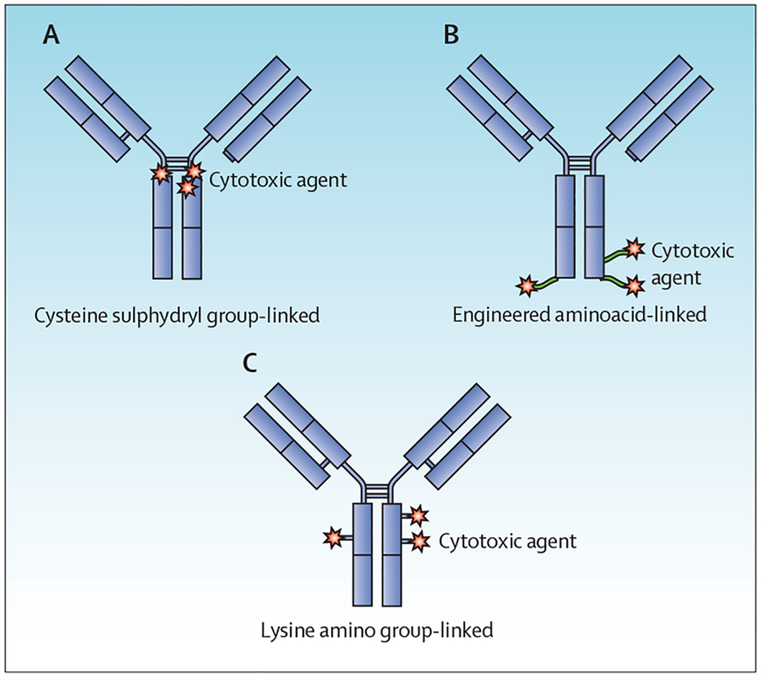
图5. ADC中连接药物的方法,doi: 10.1016/S1470-2045(16)30030-4
(A)通过链内巯基键连接;(B)通过基因工程的非天然氨基酸连接;(C)通过赖氨酸的ε氨基连接
ADC药物开发的三代技术
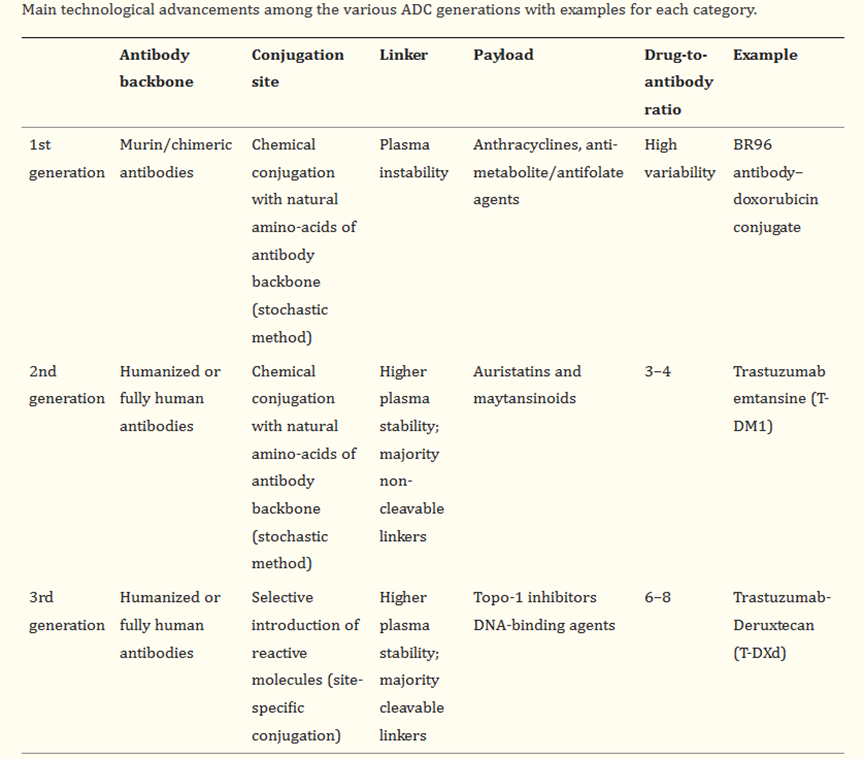
第一代ADC在循环中不稳定,导致药物的全身性损失,且由于有效载荷效力不足和不可预测的全身毒性而显示出狭窄的治疗指数。第二代和第三代ADC获得了更大的治疗指数,这些ADC依靠创新的连接子、更有效的有效载荷和位点特异性偶联来设计具有明确药物抗体比的同质ADC。此外,使用人源化抗体骨架进一步降低了ADC的免疫原性。如下表总结了各代ADC的主要技术进步,并举例说明每个类别。
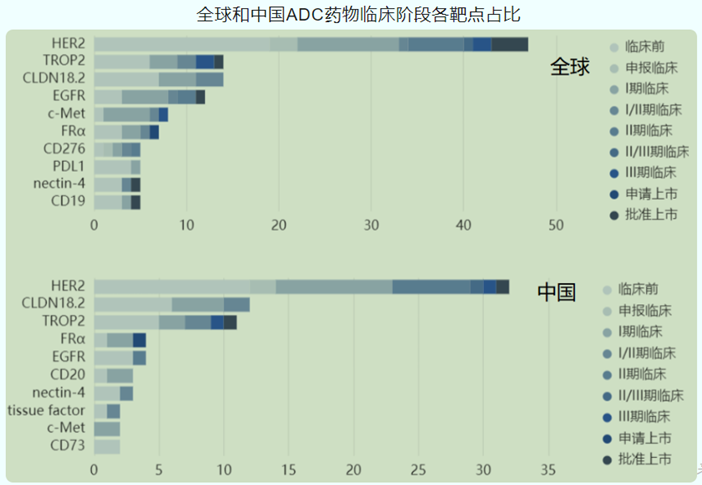
2023 ADC临床药物靶点
未来方向
(1)开发新的抗原靶点和抗体
(2)开发改进的细胞毒性和其他有效载荷
(3)免疫疗法和ADC:1)将免疫疗法与ADC联合使用; 2)将免疫疗法纳入ADC
ADC发展历程
ADC发展历程ADC发展历程


 联系我们
联系我们
 返回
返回